Új kiadványok
Az új eredmények hozzájárulnak a Rett-szindróma okainak jobb megértéséhez
Utolsó ellenőrzés: 02.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.

A Rett-szindróma egy ritka neurofejlődési rendellenesség, amelyre jelenleg nincs gyógymód vagy jó kezelés. Súlyos fizikai és kognitív tüneteket okoz, amelyek közül sok átfedésben van az autizmus spektrumzavaraival.
A Rett-szindrómát az MECP2 gén mutációi okozzák, amely magas szinten expresszálódik az agyban, és úgy tűnik, fontos szerepet játszik az idegsejtek egészségének fenntartásában. A gén az X kromoszómán található, és a szindróma elsősorban lányokat érint. A Rett-szindróma kezeléseinek kidolgozása érdekében a kutatók jobban meg akarják érteni az MECP2-t és annak agyi funkcióit.
A kutatók, köztük a Whitehead Intézet társalapítója, Rudolf Jaenisch, évtizedek óta tanulmányozzák az MECP2 gént, de a génnel kapcsolatos számos alapvető tény ismeretlen maradt. A gén által kódolt MECP2 fehérje részt vesz a génszabályozásban; kötődik a DNS-hez, és befolyásolja számos más gének expressziós szintjét, vagyis az általuk termelt fehérje mennyiségét.
A kutatók azonban nem rendelkeztek a MECP2 által érintett gének teljes listájával, és nem volt konszenzus arról, hogy a MECP2 hogyan befolyásolja ezeket a géneket.
Az MECP2 korai tanulmányai arra utaltak, hogy a fehérje represszorként működik, ami csökkenti a célgénjei expresszióját, de Jaenisch és mások kutatásai korábban kimutatták, hogy az MECP2 aktivátorként is működik, növelve a célgénjei expresszióját – és hogy eleve aktivátor lehet. Az MECP2 hatásmechanizmusa, vagyis az, hogy pontosan mit tesz a fehérje a génexpresszió változásainak okozásáért, szintén ismeretlen volt.
A technológiai korlátok megakadályozták a kutatókat abban, hogy tisztán megválaszolják ezeket a kérdéseket. Yanish, laboratóriumának posztdoktori munkatársa, Yi Liu, és Yanish korábbi laboratóriumi tagja, Anthony Flamier, aki jelenleg a Montréali Egyetem CHU Sainte-Justine kutatóközpontjának adjunktusa, élvonalbeli technikákat alkalmaztak, hogy megválaszolják az MECP2-vel kapcsolatos fennmaradó kérdéseket, és új ismereteket szerezzenek az agy egészségében és betegségeiben betöltött szerepéről.
Eredményeiket a Neuron folyóiratban tették közzé, és a kutatók létrehoztak egy online adattárat is az MECP2-adatokból, az MECP2-NeuroAtlas portált, amely más kutatók számára is hasznos forrásként szolgál.
„Azt hiszem, ez a tanulmány alapvetően megváltoztatja majd az emberek eddigi felfogását arról, hogy az MECP2 hogyan okozza a Rett-szindrómát. Teljesen új ismeretekkel rendelkezünk a mechanizmusról, és új utakat nyithat a betegség kezelésének fejlesztésében” – mondja Janisch, aki egyben az MIT biológiaprofesszora is.
Az MECP2 mélyebb megértése az agyban
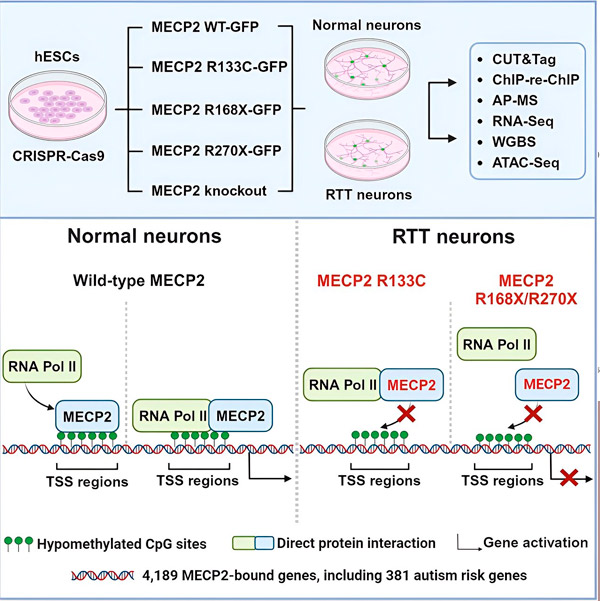
A kutatók először egy részletes térképet készítettek arról, hogy az MECP2 hol kötődik az emberi neuronális génszekvenciákhoz, akár a géneken belül, akár a DNS közelében lévő szabályozó régiókban. Egy CUT&Tag nevű megközelítést alkalmaztak, amely nagy pontossággal képes meghatározni a fehérjék és a DNS közötti kölcsönhatásokat.
A kutatók több mint 4000, a MECP2-höz kapcsolódó gént találtak. Megismételték a térképezést a Rett-szindrómával összefüggő gyakori MECP2-mutációkat tartalmazó neuronokban, hogy meghatározzák, hol hiányzik a MECP2 a betegségben.
Az MECP2 által kódolt gének ismerete lehetővé tette Liu és Flamier számára, hogy összefüggéseket keressenek a MECP2 célpontjai és az agy egészsége között. Megállapították, hogy számos célpontja részt vesz a neuronális axonok és szinapszisok fejlődésében és működésében.
Összehasonlították az MECP2 célpontok listáját a Simons Alapítvány Autizmus Kutatási Kezdeményezésének (SFARI) autizmussal összefüggő gének adatbázisával, és azt találták, hogy az adatbázisban 381 gén MECP2 célpont.
Forrás: Neuron (2024). DOI: 10.1016/j.neuron.2024.04.007
Ezek az eredmények segíthetnek tisztázni a Rett-szindróma autizmus tünetei mögött meghúzódó mechanizmusokat, és jó kiindulópontot jelenthetnek az MECP2 autizmusban betöltött lehetséges szerepének vizsgálatához.
„Elkészítettük az MECP2 epigenom első integrált térképét az egészség és a betegségek tekintetében, és ez a térkép iránymutatást adhat a jövőbeli kutatásoknak” – mondja Liu. „Annak ismerete, hogy mely gének a MECP2 célpontjai, és mely gének károsodnak közvetlenül a betegségben, szilárd alapot teremt a Rett-szindróma megértéséhez és a neuronok génszabályozásával kapcsolatos kérdések feltevéséhez.”
A kutatók azt is vizsgálták, hogy az MECP2 növelte vagy csökkentette-e a célgénjeinek expresszióját. Összhangban azzal, hogy az MECP2-t egyesek aktivátorként, mások represszorként azonosították, Liu és Flamier olyan példákat találtak, ahol az MECP2 mindkét szerepet betöltötte.
Míg azonban az MECP2-t gyakrabban represszorként tekintik, Liu és Flamier azt találták, hogy többnyire aktivátor – megerősítve Jaenisch és Liu korábbi eredményeit. Egy új kísérlet kimutatta, hogy az MECP2 a célpontjainak legalább 80%-át aktiválja, egy másik pedig azt, hogy a célpontjainak akár 88%-át is aktiválja.
A kutatók által létrehozott célgén-térkép további betekintést nyújtott az MECP2 aktivátorként betöltött szerepébe. Azt találták, hogy az MECP2 által aktivált gének esetében a gén jellemzően a gén előtti DNS-régióhoz, az úgynevezett transzkripciós starthelyhez kötődik.
Ez az a hely, ahol a sejtes mechanizmusok elindítják a gén RNS-sé történő átírásának folyamatát, majd az RNS funkcionális fehérjévé alakul, amely a génexpresszió terméke. Az MECP2 jelenléte a transzkripció starthelyén, ahol a génexpresszió megkezdődik, összhangban van génaktivátorként betöltött szerepével.
A kutatók ezután elkezdték meghatározni, hogy milyen szerepet játszik a MECP2 a génaktiválásban. Megvizsgálták, hogy a DNS mellett milyen molekulákhoz kötődik a MECP2 ezen a helyen, és azt találták, hogy a MECP2 közvetlenül kölcsönhatásba lép egy RNS-polimeráz II (RNS Pol II) nevű fehérjekomplexummal. Az RNS Pol II egy kulcsfontosságú sejtes gép, amely a DNS-t RNS-sé írja át. Az RNS Pol II önmagában nem képes megtalálni a géneket, ezért különféle kofaktorokra, vagyis fehérje-kollaborátorokra van szüksége a feladata elvégzéséhez.
A kutatók azt feltételezik, hogy az MECP2 egy ilyen kofaktorként szolgál, segítve az RNS Pol II transzkripciójának megindítását azoknál a géneken, amelyekhez az MECP2 kötődik. Az MECP2 szerkezeti elemzése azonosította a molekula azon részeit, amelyek az RNS Pol II-höz kötődnek, és más kísérletek megerősítették, hogy az MECP2 elvesztése csökkenti az RNS Pol II jelenlétét a megfelelő transzkripciós starthelyeken, valamint a célgének expressziós szintjét.
Ez arra utal, hogy a Rett-szindrómát a MECP2 által célzott gének csökkent transzkripciója okozhatja, mivel a MECP2 mutációk megakadályozzák, hogy a fehérje az RNS Pol II-höz vagy a DNS-hez kötődjön. Ezzel az elképzeléssel összhangban a betegségekkel összefüggő leggyakoribb MECP2 mutációk a csonkolások: olyan mutációk, amelyekben a fehérje egy része hiányzik, ami megváltoztathatja a MECP2 és az RNS Pol II közötti kölcsönhatást.
A kutatók remélik, hogy eredményeik nemcsak a MECP2-ről alkotott ismereteinket változtatják meg, hanem azt is, hogy az MECP2 agyfejlődésre és -működésre gyakorolt hatásának mélyebb és szélesebb körű megértése új ismeretekhez vezethet, amelyek segíthetnek a Rett-szindrómában és a kapcsolódó rendellenességekben, köztük az autizmusban szenvedőknek.
„Ez a projekt nagyszerű példa a Janisch laboratórium együttműködési jellegére” – mondja Flamier. „Rudolffal volt egy specifikus problémánk a Rett-szindrómával kapcsolatban, és tapasztalatom volt a CUT&Tag technológiával, amely megoldhatta a problémát. A megbeszélések során rájöttünk, hogy egyesíthetjük erőfeszítéseinket, és most egy nagyszerű információtárházzal rendelkezünk az MECP2-ről és annak betegségekkel való kapcsolatáról.”
