Új kiadványok
A genetikai gyulladásos betegségért felelős fehérje azonosítva
Utolsó ellenőrzés: 02.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
A Kölni Egyetem Öregedéskutatási Kiválósági Klaszterének munkatársa, Dr. Hirotsugu Oda vezette kutatócsoport felfedezte egy bizonyos fehérjekomplex szerepét az immunszabályozás bizonyos formáiban. Ez az eredmény új terápiás megközelítések kifejlesztéséhez vezethet, amelyek célja az autoinfláció csökkentése és az immunrendszer „helyreállítása” azoknál a betegeknél, akik ezen fehérjekomplex genetikai diszfunkciójában szenvednek.
A „Biallelikus humán SHARPIN funkcióvesztés autoinflammációt és immunhiányt indukál” című tanulmány a Nature Immunology folyóiratban jelent meg.
A HOIP, HOIL-1 és SHARPIN fehérjékből álló lineáris ubiquitin-összeszerelő komplex (LUBAC) régóta elismert kritikus szerepe az immunhomeosztázis fenntartásában. Korábbi egereken végzett vizsgálatok kimutatták a SHARPIN-veszteség súlyos következményeit, ami a túlzott bőrsejt-halál miatt súlyos dermatitiszhez vezet. Az emberi szervezetben a SHARPIN-hiány konkrét egészségügyi következményei azonban továbbra sem tisztázottak.
A kutatócsoport elsőként számolt be két SHARPIN-hiányos személyről, akik autoinfláció és immunhiány tüneteit mutatják, de váratlanul nem mutatnak bőrgyógyászati problémákat, mint az egereknél.
További vizsgálatok során kiderült, hogy ezeknél az egyéneknél károsodott a kanonikus NF-κB válasz, amely egy fontos immunválaszútvonal. Emellett fokozott fogékonyságot mutattak a tumor nekrózis faktor (TNF) szupercsalád tagjai által kiváltott sejthalálra. Egy SHARPIN-hiányos beteg anti-TNF terápiával történő kezelése, amely specifikusan gátolja a TNF által kiváltott sejthalált, a sejtek szintjén és a klinikai tünetekben is teljes mértékben megoldotta az autoinflációt.
A tanulmány kimutatta, hogy a túlzott és kontrollálatlan sejthalál kritikus szerepet játszik a genetikai eredetű emberi gyulladásos betegségekben. Oda csapata a SHARPIN-hiányt is hozzáadta a genetikai eredetű emberi gyulladásos betegségek csoportjához, amelyeket „veleszületett sejthalál-hibáknak” neveznek.
Védelem az immunszabályozás zavara ellen A tanulmányt Dr. Dan Kastner laboratóriumában indították az Egyesült Államok Nemzeti Egészségügyi Intézeteiben (NIH). A tudósoknak lehetőségük volt megfigyelni egy beteget, akinél gyermekkorban jelentkeztek megmagyarázhatatlan lázas, ízületi gyulladásos, vastagbélgyulladásos és immunhiányos epizódok.
A tájékoztatáson alapuló beleegyezés megszerzése után exomszekvenálást végeztek a betegen és családtagjain, és megállapították, hogy a betegnél egy pusztító genetikai variáns volt a SHARPIN génben, ami a SHARPIN fehérje kimutathatatlan szintjéhez vezetett. Azt is megállapították, hogy a beteg sejtjei fokozott hajlamot mutattak az elhalásra mind a tenyésztett sejtekben, mind a beteg biopsziáiban.
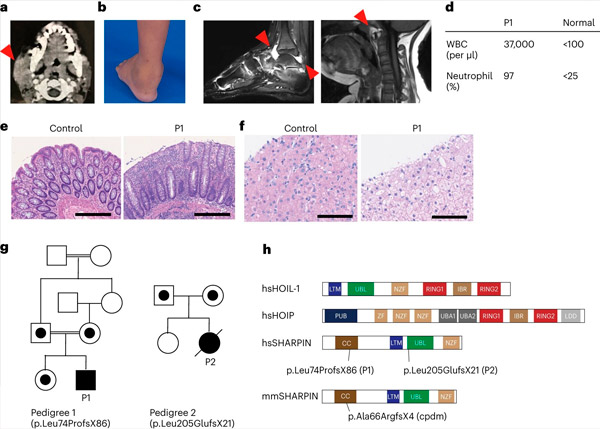
A SHARPIN hiánya emberekben autoinflammatorikus gyulladást és májglikogenózist okoz. Forrás: Nature Immunology (2024). DOI: 10.1038/s41590-024-01817-w
A csapat azt is megállapította, hogy a limfoid germinális központok – az adenoidokban található specializált mikrostruktúrák, amelyek kritikus fontosságúak az immunrendszer B-sejtjeinek éréséhez, és ezáltal az antitesttermeléshez – fejlődése jelentősen csökkent a megnövekedett B-sejthalál miatt. Ezek az eredmények magyarázzák a betegek immunhiányos állapotát, és rávilágítanak a LUBAC fontos szerepére az immunhomeosztázis fenntartásában emberekben.
„Tanulmányunk kiemeli a LUBAC kritikus fontosságát az immunszabályozási zavarok elleni védelemben. Az LUBAC-hiány mögött meghúzódó molekuláris mechanizmusok feltárásával utat nyitunk az immunhomeosztázis helyreállítását célzó új terápiás stratégiák előtt” – mondta Oda, a tanulmány vezető szerzője.
Hozzátette: „Az egyik SHARPIN-hiányos beteg évekig kerekesszékhez volt kötve, mielőtt először láttuk. A bokái begyulladtak, és túl fájdalmas volt a járás. A genetikai diagnózis lehetővé tette számunkra, hogy megcélozzuk az állapota mögött meghúzódó helyes molekuláris útvonalat.”
Amióta a beteg anti-TNF terápiát kezdett kapni, közel hét éve tünetmentes. „Klinikusként és tudósként örülök, hogy lehetőségem van pozitív hatással lenni egy beteg életére a kutatásunkon keresztül” – zárta Oda.
