Új kiadványok
A talidomid vegyületek származékai a rezisztens rákos sejtek pusztulásához vezetnek
Utolsó ellenőrzés: 02.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
A frankfurti Goethe Egyetem által végzett tanulmány rámutat arra a lehetőségre, hogy a thalidomid-származékok potenciálisan felhasználhatók a rák kezelésére. A thalidomidot az 1950-es években altatóként árulták. Később arról vált hírhedtté, hogy súlyos születési rendellenességeket okoz a terhesség korai szakaszában.
A molekuláról az is ismert, hogy megjelöli a sejtekben lévő fehérjéket a pusztítás céljából. A jelenlegi tanulmány részeként a tudósok a talidomid származékait állították elő. Kimutatták, hogy ezek az anyagok befolyásolják a rákos sejtek túléléséért felelős fehérjék pusztulását.
Talán egyetlen más molekulának sem volt olyan viharos múltja, mint a talidomidnak. Ez volt a fő összetevője egy olyan gyógyszernek, amelyet az 1950-es években számos országban nyugtatóként és altatóként engedélyeztek. De hamarosan világossá vált, hogy a talidomidot szedő terhes nők gyakran súlyos deformitású csecsemőket hoztak világra.
Az utóbbi évtizedekben azonban az orvostudomány ismét nagy reményeket fűz hozzá. Tanulmányok kimutatták többek között, hogy gátolja az erek növekedését, és ezért potenciálisan alkalmas a daganatok táptalajuktól való elzárására. Ezután a csontvelőben kialakuló rosszindulatú daganatok, a mielóma multiplex kezelésében is nagyon hatékonynak bizonyult.
„Most már tudjuk, hogy a talidomidot „molekuláris ragasztónak” nevezhetjük” – magyarázza Dr. Xinglai Cheng, a Frankfurti Goethe Egyetem Gyógyszerészeti Kémiai Intézetének munkatársa. „Ez azt jelenti, hogy képes két fehérjét megragadni és összekapcsolni.”
Ez különösen érdekes, mert ezek közül a fehérjék közül az egyik egyfajta „címkézőgép”: egy egyértelmű „SZEMÉT” címkét ragaszt egy másik fehérjéhez.
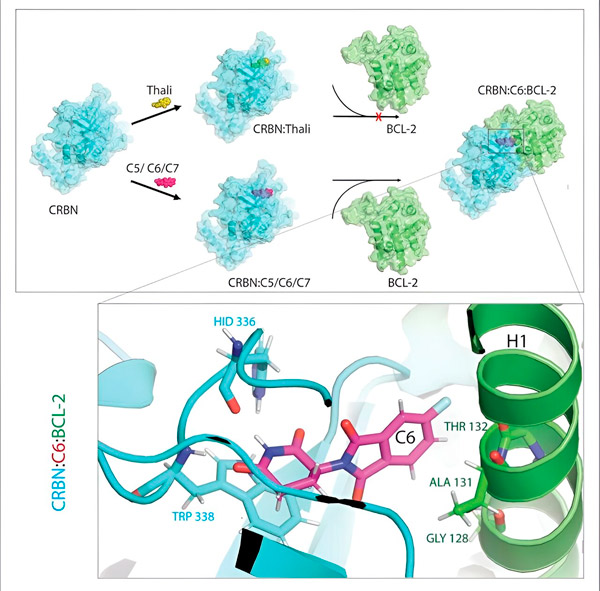
A talidomid származékok, a C5, C6 és C7 megváltoztatják a CRBN-t, a „címkézőgépet”, így az képes kötődni a BCL-2-höz. Ily módon a BCL-2 molekula megjelölésre kerül a lebontáshoz – ez egy lehetséges új stratégia a rák elleni küzdelemben. Szerző: Dr. Xinglai Cheng.
A sejt salakanyag-kezelő rendszere felismeri ezt a jelölőt: megragadja a megjelölt fehérjemolekulát és felaprítja. „Ez a mechanizmus magyarázza a talidomid különböző hatásait” – mondja Cheng. „Attól függően, hogy melyik fehérjét jelöli meg, deformitásokat okozhat az embrionális fejlődés során, vagy elpusztíthatja a rosszindulatú sejteket.”
Ez a mechanizmus hatalmas lehetőségeket nyit az orvostudomány számára, mivel a rákos sejtek túlélése bizonyos fehérjéktől függ. Ha ezeket szisztematikusan megcélozhatnák és felapríthatnák, talán a betegség gyógyítható lenne. A probléma az, hogy a molekuláris ragasztó meglehetősen különös.
Az egyik kötőpartnere mindig a sejt jelölőgépe, vagy tudományos nyelven egy CRBN nevű E3 ligáz. A szervezetben található sok ezer fehérje közül csak nagyon kevés lehet második partner – hogy melyek, az a ragasztótól függ.
„Így hát létrehoztunk egy sor talidomid-származékot” – mondja Cheng. „Ezután teszteltük, hogy rendelkeznek-e adhéziós tulajdonságokkal, és ha igen, mely fehérjék ellen hatékonyak.” Ehhez a kutatók a tenyésztett sejtvonal összes fehérjéjéhez hozzáadták származékaikat. Ezután megfigyelték, hogy ezek közül a fehérjék közül melyek bomlottak le CRBN jelenlétében.
„A folyamat során három olyan származékot azonosítottunk, amelyek képesek megjelölni egy, a lebontáshoz nagyon fontos sejtfehérjét, a BCL-2-t” – magyarázza Cheng. „A BCL-2 megakadályozza, hogy a sejtek aktiválják önpusztító programjukat, így ha nincs jelen, a sejtek elpusztulnak.”
Ezért áll a BCL-2 régóta a rákkutatás középpontjában. Létezik egy leukémia gyógyszer is, a venetoclax, amely csökkenti a BCL-2 hatékonyságát, és ezáltal a mutált sejtek önpusztulását okozza.
„Sok rákos sejtben azonban maga a BCL-2 is mutálódik. Ennek eredményeként a venetoclax már nem gátolja a fehérjét” – mondja Cheng. „Ki tudtuk mutatni, hogy származékaink ezt a mutált formát is jelzik lebontásra. Ezenkívül a Max Planck Biofizikai Intézetben dolgozó partnereink számítógépen szimulálták a talidomid-származékok és a BCL-2 kölcsönhatását. Ez azt mutatta, hogy a származékok teljesen más helyekhez kötődnek, mint a venetoclax – ezt az eredményt később kísérletileg is meg tudtuk erősíteni.”
A kutatók rákos sejteket hordozó gyümölcslegyeken is tesztelték vegyületeiket. Az így kezelt legyek túlélési aránya jelentősen magasabb volt. Cheng azonban óvatosságra int, ne fűzzünk túl nagy reményeket, mivel ezek az eredmények még mindig alapkutatási jellegűek. „Bár azt mutatják, hogy a módosított talidomid molekulák nagy terápiás potenciállal rendelkeznek, még nem tudjuk megmondani, hogy valamikor a gyakorlatban is bizonyítják-e létjogosultságukat.”
A tanulmány eredményeit a Cell Reports Physical Science folyóiratban tették közzé.
