Új kiadványok
A tudósok "kaméleon" vegyületet hoztak létre a gyógyszerrezisztens agydaganatok kezelésére
Utolsó ellenőrzés: 02.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
A Yale Egyetem tudósai által végzett új tanulmány leírja, hogyan támadja meg egy új kémiai vegyület a gyógyszerrezisztens agydaganatokat anélkül, hogy károsítaná a környező egészséges szöveteket.
A Journal of the American Chemical Society című folyóiratban megjelent tanulmány fontos lépés az úgynevezett „kaméleonvegyületek” fejlesztésében, amelyek számos veszélyes rákfajta elleni küzdelemben alkalmazhatók.
Gliomák évente körülbelül 6,6 esetben alakulnak ki 100 000 emberből, és 14 éves korukra 2,94 esetben 100 000 emberből. A központi idegrendszert elérő más rákos megbetegedések áttéteit leszámítva a gliómák az összes agydaganat (primer agydaganatok) 26%-át és az összes rosszindulatú agydaganat 81%-át teszik ki.
Évtizedek óta a glioblasztómás betegeket temozolomid nevű gyógyszerrel kezelik. A legtöbb betegnél azonban egy éven belül rezisztencia alakul ki a temozolomiddal szemben. A glioblasztómás betegek ötéves túlélési aránya kevesebb, mint 5%.
2022-ben Seth Herzon, a Yale vegyésze és Dr. Ranjit Bindra, a sugárterápiás onkológus új stratégiát dolgozott ki a glioblasztómák hatékonyabb kezelésére. Létrehoztak egy kaméleonvegyületeknek nevezett rákellenes molekulaosztályt, amely egy O6-metilguanin DNS-metiltranszferáz (MGMT) néven ismert DNS-javító fehérje hibáját használja ki.
Sok rákos sejtből, beleértve a glioblasztómákat is, hiányzik az MGMT fehérje. Az új kaméleonvegyületeket úgy tervezték, hogy károsítsák az MGMT-t nem tartalmazó tumorsejtek DNS-ét.
A kaméleonvegyületek DNS-károsodást idéznek elő azáltal, hogy elsődleges léziókat hoznak létre a DNS-en, amelyek idővel rendkívül mérgező másodlagos léziókká, úgynevezett szálak közötti keresztkötésekké alakulnak. Az MGMT védi az egészséges szövetek DNS-ét azáltal, hogy kijavítja az elsődleges léziókat, mielőtt azok halálos szálak közötti keresztkötésekké alakulhatnának.
Új tanulmányukban Herzon és Bindra társszerzők a KL-50-es kaméleonjukra összpontosítottak.
„Szintetikus kémia és molekuláris biológiai vizsgálatok kombinációját alkalmaztuk korábbi megfigyeléseink molekuláris alapjainak, valamint ezen vegyületek egyedülálló szelektivitását biztosító kémiai kinetika tisztázására” – mondta Herzon, a Yale Egyetem Milton Harris kémiaprofesszora. „Megmutatjuk, hogy a KL-50 egyedülálló abban, hogy csak hibás DNS-javítású tumorokban képez DNS-keresztkötéseket. Az egészséges szöveteket kíméli.”
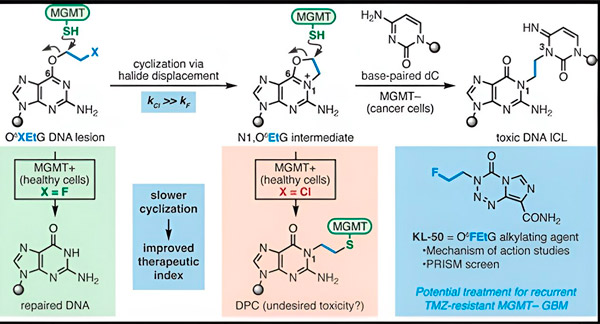
Forrás: Journal of the American Chemical Society (2024). DOI: 10.1021/jacs.3c06483
Ez jelentős különbség, mutatnak rá a kutatók. Számos más rákellenes vegyületet is úgy terveztek, hogy kiváltsa a szálak közötti keresztkötéseket, de ezek nem szelektívek a tumorsejtekre, ami korlátozza a hasznosságukat.
A kutatók megjegyezték, hogy a KL-50 sikerének titka az időzítésében rejlik. A KL-50 lassabban képez szálak közötti keresztkötéseket, mint más keresztkötők. Ez a késleltetés elegendő időt ad az egészséges sejteknek az MGMT felhasználására a keresztkötések kialakulásának megakadályozására.
„Ez az egyedülálló profil arra utal, hogy potenciálisan kezelésre alkalmas a gyógyszerrezisztens glioblasztóma esetében, amely terület nagy, kielégítetlen igényekkel küzd a klinikumban” – mondta Bindra, a Yale Orvostudományi Kar Harvey és Kate Cushing terápiás radiológiai professzora. Bindra a Smilo Kórház Chenevert Családi Agydaganat Központjának tudományos igazgatója is.
Herzon és Bindra szerint tanulmányuk rávilágít a kémiai DNS-módosítás és a biokémiai DNS-javítás mértékének figyelembevételének fontosságára. Úgy vélik, hogy ezt a stratégiát felhasználhatják más, specifikus, tumorral összefüggő DNS-javítási hibákat tartalmazó rákos megbetegedések kezelésének fejlesztésére.
