Új kiadványok
A tudósok nyomon követik a rákot okozó legkorábbi fizikai változásokat a sejtekben
Utolsó ellenőrzés: 02.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
Amikor rákot diagnosztizálnak, már számos sejtes és molekuláris szintű esemény zajlik, amelyek eddig észrevétlenül zajlottak. Bár a rákot klinikai célokra korai és késői stádiumra osztják, még a „korai” stádiumú daganat is a szervezetben korábban bekövetkezett, észrevehetetlen változások eredménye.
A Yale Egyetem Orvostudományi Karának (YSM) tudósai és kollégáik most részletes betekintést nyertek e korai változások némelyikébe, nagy felbontású mikroszkóppal követve nyomon az egér bőrsejtjeiben bekövetkező legelső rákkeltő fizikai változásokat.
A tudósok olyan egerek vizsgálatával, amelyeknél a szőrtüszőkben rákot okozó mutáció alakult ki, azt találták, hogy a rák kialakulásának első jelei az egerek szőrtüszőinek növekedésében egy meghatározott időpontban és helyen jelentkeznek. Sőt, azt is megállapították, hogy ezek a rákmegelőző változások blokkolhatók a MEK-gátlóként ismert gyógyszerekkel.
A csapatot PhD Tianchi Xin, az YSM Genetikai Tanszékének kutatója vezette, tagjai között volt Dr. Valentina Greco, az YSM genetikaprofesszora, a Yale Rákközpont és a Yale Őssejtközpont tagja, valamint Dr. Sergi Regot, a Johns Hopkins Orvostudományi Kar molekuláris biológia és genetika docense.
Kutatásuk eredményeit a Nature Cell Biology folyóiratban tették közzé.
A tudósok olyan egereket vizsgáltak, amelyeknél laphámsejtes karcinóma alakult ki, amely a második leggyakoribb bőrráktípus az emberekben. Ezeket az egereket genetikailag módosították a KRAS génben lévő rákkeltő mutációval, amely az egyik leggyakrabban mutált onkogén az emberi rákos megbetegedésekben. A KRAS mutációkat tüdő-, hasnyálmirigy- és vastagbélrákban is kimutatták.
A tudósok által vizsgált korai változások között szerepelt egy apró, rendellenes dudor növekedése a szőrtüszőben, amelyet rákmegelőző rendellenességnek minősítenek. „Ezeknek a korai eseményeknek a megértése segíthet olyan megközelítések kidolgozásában, amelyekkel megelőzhető a rák kialakulásának vége” – mondta Xin, a tanulmány első szerzője.
Bár tanulmányuk a bőrrákra összpontosít, a kutatók úgy vélik, hogy az általuk felfedezett elvek számos más, a KRAS-mutációk által okozott rákos megbetegedésre is alkalmazhatók, mivel az ezekben a folyamatokban részt vevő kulcsfontosságú gének és fehérjék ugyanazok a daganatokban.
Több, mint pusztán sejtszaporodás Mind az emberekben, mind az egerekben a szőrtüszők folyamatosan nőnek, vedlenek a régi szőrszálak és újak képződnek. Az őssejtek, amelyek képesek különböző sejttípusokká fejlődni, nagy szerepet játszanak ebben a megújulási folyamatban. Korábbi tanulmányok kimutatták, hogy a KRAS-mutációk fokozott őssejt-proliferációhoz vezetnek a szőrtüszőkben, és ezt a nagymértékű őssejt-növekedést feltételezték a rákmegelőző szöveti rendellenességért.
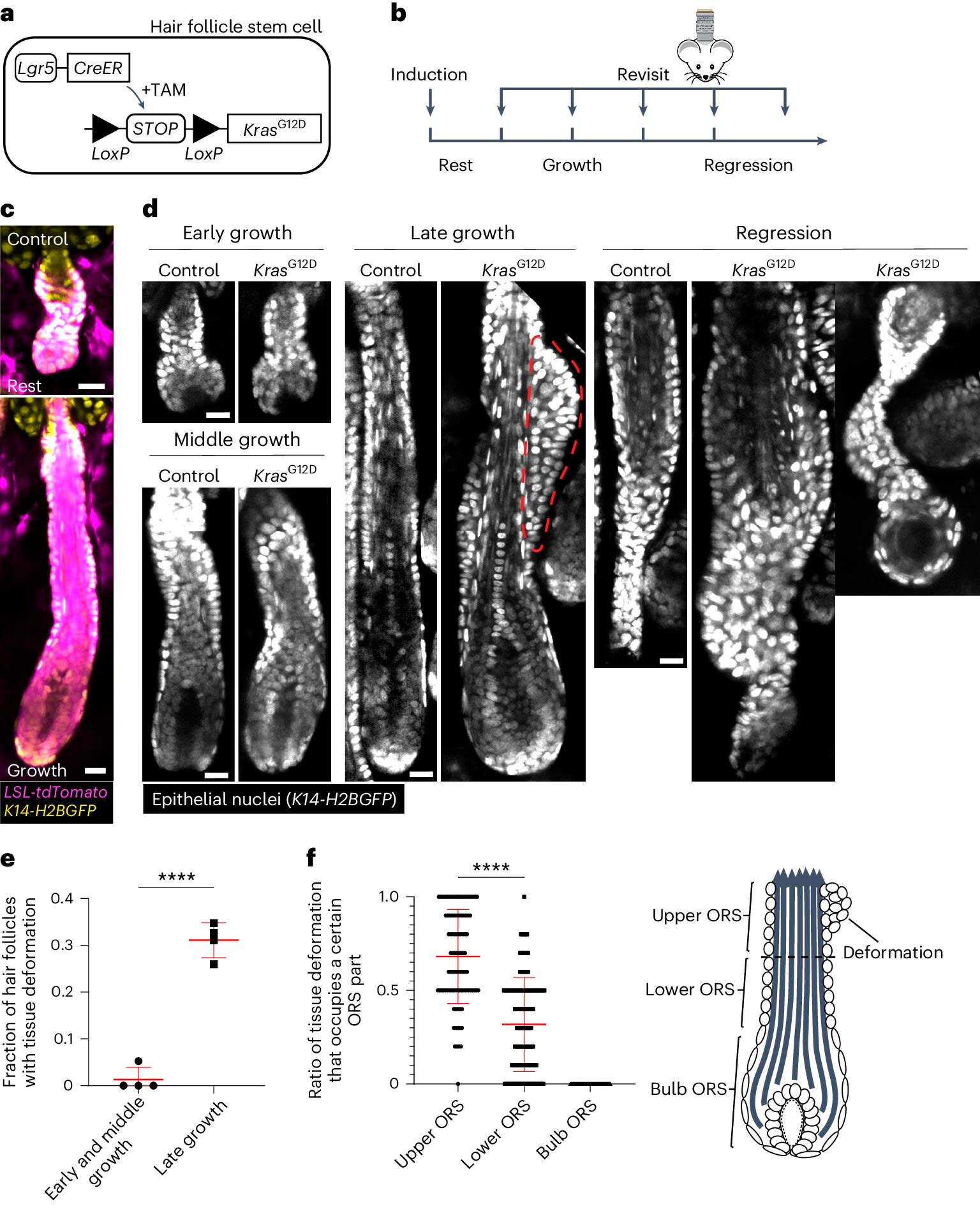
A KrasG12D térbeli és időbeli specifikus szöveti deformációkat indukál a hajhagymás regenerációja során.
A. A KrasG12D hajhagymás őssejtekben történő indukálására szolgáló genetikai megközelítés vázlata a tamoxifen által indukálható Cre-LoxP (TAM) rendszer alkalmazásával.
B. A KrasG12D indukciójának és újra-képalkotásának időzítését bemutató vázlat a hajciklus szakaszaihoz viszonyítva.
C. A Cre által indukálható tdTomato (Magenta) riportert tartalmazó vad típusú nyugalmi és növekvő hajhagymák reprezentatív képei az indukció után.
D. A kontroll és a KrasG12D hajhagymák reprezentatív képei a hajciklus különböző szakaszaiban. A külső gyökérhüvelyben (ORS) lévő tuberkulumok formájában megjelenő szöveti deformációt a piros szaggatott vonal jelzi.
E. A szöveti deformációval rendelkező KrasG12D hajhagymák aránya a hajhagymás növekedésének különböző szakaszaiban.
F. Az ORS felső, alsó és hagymás részét elfoglaló szöveti deformációk aránya az egyes KrasG12D hajhagymák esetében.
Forrás: Nature Cell Biology (2024). DOI: 10.1038/s41556-024-01413-y
Az ötlet teszteléséhez a csapat egy speciálisan létrehozott mutált KRAS-formát használt, amelyet meghatározott időpontokban aktiváltak az állatok szőrtüszőinek bőrsejtjeiben. Xin és kollégái az intravitális képalkotás néven ismert mikroszkópos technikát alkalmazták, amely lehetővé teszi a sejtek nagy felbontású képeinek in vivo készítését, valamint az állatok egyes őssejtjeinek megjelölését és nyomon követését.
Amikor a KRAS-mutáció aktiválódott, az összes őssejt gyorsabban kezdett szaporodni, de a rákmegelőző dudor csak a szőrtüsző egy adott helyén és a növekedés egy szakaszában alakult ki, ami azt jelenti, hogy a sejtek számának általános növekedése valószínűleg nem a teljes történet.
A hajhagymákban a KRAS-mutáció aktiválódása azt eredményezte, hogy az őssejtek gyorsabban szaporodtak, megváltoztak migrációs mintázataik, és különböző irányokba osztódtak a rákot elősegítő mutáció nélküli sejtekhez képest.
A mutáció egy ERK néven ismert fehérjét érint. A Xin valós időben tudta monitorozni az ERK aktivitását élő állatok egyes őssejtjeiben, és egy specifikus változást talált a fehérje aktivitásában, amelyet a KRAS-mutáció okozott. A kutatóknak egy MEK-gátló segítségével sikerült megállítaniuk a rákmegelőző csomó kialakulását, amely blokkolja az ERK aktivitását.
A gyógyszer megállította a mutáció hatását a sejtek migrációjára és orientációjára, de nem az őssejtek teljes proliferációjára, ami azt jelenti, hogy a rákmegelőző állapot kialakulását ez az első két változás vezérli, nem pedig a fokozott sejtszaporodás.
Rákot megelőző változások kontextusban Egy onkogén mutáció élő szervezetben betöltött valós idejű hatásainak nyomon követése az egyetlen módja annak, hogy a kutatók feltárják ezeket az elveket. Ez azért fontos, mert a rákos megbetegedések nem vákuumban alakulnak ki – növekedésükhöz és fenntartásukhoz nagymértékben támaszkodnak mikro-környezetükre. A tudósoknak nemcsak az egyes sejtek viselkedését, hanem a bennük lévő molekulákat is nyomon kellett követniük.
„Az onkogén események megértéséhez alkalmazott megközelítésünk valójában a léptékek közötti összekapcsolódásról szól” – mondta Greco. „Dr. Xin és Dr. Regot által alkalmazott struktúra és megközelítések lehetővé tették számunkra, hogy lemenjünk a molekuláris elemekig, összekapcsoljuk azokat a sejtek és a szövetek szintjével, és olyan megoldást kínáljanak ezekre az eseményekre, amelyet egy élő szervezeten kívül olyan nehéz lenne elérni.”
A kutatók most hosszabb időn keresztül szeretnék követni a folyamatot, hogy lássák, mi történik a kezdeti dudor kialakulása után. Más onkogén eseményeket, például a gyulladást is tanulmányozni akarnak, hogy kiderüljön, az általuk felfedezett elvek más kontextusokban is alkalmazhatók-e.
