Új kiadványok
Az LM11A-31 gyógyszer lassítja az Alzheimer-kór progresszióját a vizsgálatban
Utolsó ellenőrzés: 02.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.

A Nature Medicine folyóiratban megjelent egyik friss tanulmányban a tudósok egy randomizált, kettős vak, placebo-kontrollos 2a fázisú vizsgálatot végeztek, hogy megvizsgálják az LM11A-31 biztonságosságát és hatékonyságát az Alzheimer-kór (AD) kezelésében a p75 neurotrofin receptor (p75NTR) modulációján keresztül.
Az Alzheimer-kór (AD) a demencia leggyakoribb formája, amelyet szinaptikus elégtelenség, degeneráció és az idegsejtek pusztulása jellemez. Bár az AD kezelésére szolgáló két vezető gyógyszer az abnormális amiloid-β vagy tau fehérjék felhalmozódását célozza meg, a patofiziológiának csak egy részét kezelik. Egy másik megközelítés magában foglalja az alapvető biológiai útvonalakat befolyásoló receptorok és jelátviteli hálózatok célbavételét. A preklinikai vizsgálatok azt mutatják, hogy a p75NTR modulálása egy új, kis kémiai molekulával, az LM11A-31-gyel csökkenti az amiloid és az abnormális tau által okozott szinaptikus veszteséget.
A tanulmány leírása
Ebben a randomizált klinikai vizsgálatban a kutatók azt vizsgálták, hogy az LM11A-31 lassíthatja-e az Alzheimer-kór progresszióját az emberekben a p75NTR modulálásával.
A vizsgálatban résztvevők 26 héten keresztül 242 enyhe vagy közepesen súlyos asztmában szenvedő betegnek adtak LM11A-31 orális kapszulákat 200 mg és 400 mg dózisban, vagy placebót 1:1:1 arányban. A résztvevőknek biológiailag igazolt Alzheimer-kórjuk volt (a cerebrospinális folyadék amiloid β protein 42 (Aβ42) szintje 550 ng/l alatt vagy Aβ42:β40 arány 0,89 alatt), amelyet a McKhann-kritériumok szerint diagnosztizáltak, a Mini-Psychiatric Examination (MMSE) pontszáma 18-26, a Geriátriai Depresszió Skála (GDS) pontszáma 5,0 alatt, a módosított Hachinski Ischaemiás Skála (HIS) pontszáma ≤ 4,0, a formális iskolai végzettség ≥ 8 év, és a korábbi ≥ 6 hónapos kognitív hanyatlásuk volt.
A jogosult résztvevők a vizsgálatba való belépés előtt ≥ 3 hónapig acetilkolinészteráz-gátlókat (AChEI) vagy részleges NMDA-receptor-antagonistákat szedtek. Nem szedtek illegális szereket, például antipszichotikumokat, benzodiazepineket, antiepileptikumokat, nyugtatókat, központilag ható vérnyomáscsökkentőket, nootropikumokat (a ginkgo biloba kivételével) vagy opioid tartalmú fájdalomcsillapítókat.
A vizsgálat elsődleges kimenetele a biztonságosság és a tolerálhatóság volt, amelyet a Columbia Suicidal Thoughts and Behavior Severity Rating Scale (C-SSRS), az életjelek, a vérnyomás és a hematológiai paraméterek alapján értékeltek. A másodlagos kognitív eredmények értékelésére strukturális mágneses rezonancia képalkotást (cMRI), fluorodeoxiglükóz pozitronemissziós tomográfiát (FDG-PET) és agy-gerincvelői folyadék (CSF) biomarkereit használták. Az Alzheimer-kór mérései közé tartozott a Thr181-foszforilált tau, a teljes tau fehérje, az Aβ40, Aβ42 és az AChE aktivitás. A csapat egy személyre szabott neuropszichológiai tesztet alkalmazott a másodlagos kognitív eredmények értékelésére a kiindulási állapotban, a 12. és a 26. héten.
Kutatási eredmények
A tanulmány megállapította, hogy az LM11A-31 biztonságos és jól tolerálható, jelentős biztonsági aggályok nélkül. A leggyakoribb mellékhatások közé tartozott a fejfájás, hasmenés, eozinofília és nazofaringitisz, a gyomor-bélrendszeri problémák és az eozinofília voltak a kezelés abbahagyásának fő okai. A 400 mg-os csoportban több beteg hagyta abba a kezelést, mint a 200 mg-os és a placebo csoportban. Az MRI nem mutatott ki biztonsági aggályokat, beleértve az amiloiddal kapcsolatos rendellenességeket is. A két kezelési csoport között nem volt szignifikáns különbség a kognitív pontszámokban vagy az amiloid rendellenességekben.
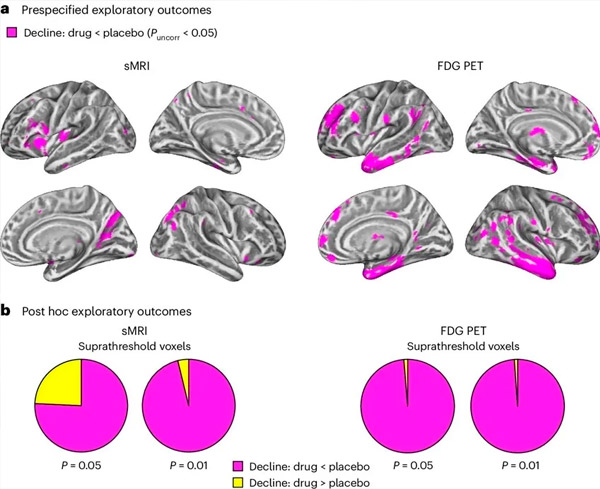
A. A kovariancia kétirányú vegyes modellanalízisével vizsgálták a kezelés (gyógyszer vagy placebo) és az idő (kezelés előtt vagy után) közötti interakciókat. Az interakciós hipotézist (a gyógyszer lassítja a progressziót a placebóhoz képest) vizsgáló egyoldali t-kontraszt kimutatta, hogy az LM11A-31 kezelés lassította a longitudinális degenerációt (bal panelek) és a glükóz hipometabolizmust (jobb panelek) a gyógyszeres csoportban (cMRI, n = 127; PET, n = 121) a placebo csoporthoz képest (cMRI, n = 66; PET, n = 62). Az ezt az interakciót mutató voxeleket korrigálatlan P < 0,05 küszöbértéken (bíborvörös) mutatjuk be egy populációspecifikus kéreg felszínén. A bal és jobb agyfélteke a felső, illetve az alsó sorban látható. A hipotézissel ellentétes interakciókat mutató agyterületek a 7. ábrán láthatók a kiegészítő adatokban.
B. Az előre meghatározott, sérülékeny Alzheimer-kóros agyi régiókban található voxelek teljes száma (kördiagramok teljes területe), amelyek vagy a hipotézissel összhangban lévő (bíborvörös), vagy a hipotézissel ellentétes (sárga) interakciót mutatnak az egyes képalkotó modalitásokban (cMRI, bal panel; FDG PET, jobb panel) egyre liberálisabb, korrigálatlan P < 0,01 és P < 0,05 küszöbértékek mellett. A Monte Carlo szimulációk azt mutatták, hogy a hipotézissel összhangban lévő és a hipotézissel ellentétes hatásokat mutató voxelek aránya szignifikánsan magasabb volt, mint a cMRI és a PET esetében véletlenszerűen generált adatok alapján megfigyeltek (P < 0,001 mindkét modalitásnál; kétoldali próba).
Az LM11A-31 hatékonyan csökkentette a cerebrospinális folyadékban (CSF) az Aβ42 és Aβ40 szintjének növekedését a placebo csoporthoz képest. A gyógyszer a preszinaptikus fehérje biomarker SNAP25 medián éves százalékos változásának csökkenését, valamint a posztszinaptikus biomarker NG szintjének csökkenését is kimutatta, ami a preszinaptikus és posztszinaptikus kapcsolatok elvesztésének lassulását jelzi. Az LM11A-31 csökkentette az YKL40 növekedését is, ami az MMSE pontszámok csökkenéséhez és az ADAS-Cog-13 pontszámok növekedéséhez vezetett. A gyógyszer csökkentette a szürkeállomány-veszteséget a frontális lebenyben és a hátsó parietális kéregben, valamint a glükózanyagcsere csökkenését olyan területeken, mint az entorhinális kéreg, a temporális kéreg, a hippocampus, az insuláris kéreg és a prefrontális kéreg.
Következtetés
A tanulmány arra a következtetésre jutott, hogy a p75NTR LM11A-31 általi modulációja alkalmas nagyobb klinikai vizsgálatokra. Az LM11A-31 megfelelt az elsődleges biztonságossági végpontnak, és enyhe és súlyos Alzheimer-kórban szenvedő betegek jól tolerálták. Az eredmények azt jelzik, hogy további, hosszabb kezelési időtartamú vizsgálatokra van szükség annak érdekében, hogy felmérjék a kis molekulák p75NTR-t szabályozó potenciálját, mint betegségmódosító terápiát Alzheimer-kórban. A tanulmány kimutatta, hogy az LM11A-31 jelentősen befolyásolta számos biomarkert, beleértve az Aβ40-et, Aβ42-t, SNAP25-öt, NG-t és YKL40-et, ami a kóros progresszió lassulására utal. A jövőbeli vizsgálatok a gliasejtek egészségének további mutatóit is értékelhetik.
