Új kiadványok
A csontritkulásban a csonttömeg csökkenésének megelőzésében kulcsfontosságú fehérje azonosítva
Utolsó ellenőrzés: 02.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
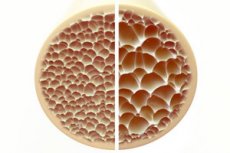
A csontritkulás, egy olyan állapot, amelyet porózus és törékeny csontok jellemeznek, jelentős veszélyt jelent a csontváz egészségére. A csontok, mint az emberi test elsődleges szerkezeti támasztéka, létfontosságú támaszt nyújtanak. Amikor a csonttömeg csökken, az nemcsak ezt a támaszt rontja, hanem az általános funkciót is, ami az életminőség romlásához vezet.
Ahogy az idősödő népességben növekszik a csontritkulás előfordulása, egyre nagyobb teher nehezedik az egészségügyi erőforrásokra a hosszú távú ellátás terén. Ezért fontos megérteni a csontritkulás kialakulásához hozzájáruló mechanizmusokat, és hatékony, célzott kezeléseket kidolgozni a hosszú távú hatások minimalizálása érdekében.
Az oszteoblasztok és az oszteoklasztok két olyan sejttípus, amelyek kulcsszerepet játszanak a csontszövet fenntartásában és átalakításában. Míg az oszteoblasztok csontképző sejtek, amelyek az új csontszövet szintéziséért és lerakódásáért felelősek, az oszteoklasztok csontlebontó sejtek, amelyek a régi vagy sérült csontszövet lebontásában és eltávolításában vesznek részt.
Az oszteoklasztok arányának növekedése csontvesztéshez vezet olyan állapotokban, mint a csontritkulás, a reumatoid artritisz (ízületi gyulladás) és a csontáttétek (a csontokba átterjedt rák). Az oszteoklasztok a makrofágok vagy monociták, az immunsejtek egy típusának differenciálódásából keletkeznek.
Így az oszteoklaszt differenciálódás gátlása terápiás stratégiaként szolgálhat a csontvesztés megelőzésére. A csontátépülés komplex folyamatát szabályozó pontos molekuláris mechanizmusok azonban továbbra sem tisztázottak.
Egy új tanulmányban Tadayoshi Hayata professzor, Takuto Konno úr és Hitomi Murachi asszony a Tokiói Tudományegyetemről kollégáikkal együtt az oszteoklaszt differenciálódás molekuláris szabályozását vizsgálták. A nukleáris faktor kappa B ligand (RANKL) receptor aktivátorával történő stimuláció a makrofágok oszteoklasztokká történő differenciálódását idézi elő.
Ezenkívül a csontmorfogenetikus fehérje (BMP) és a transzformáló növekedési faktor (TGF)-β jelátviteli útvonalak szerepet játszanak a RANKL által közvetített oszteoklaszt-differenciálódás szabályozásában. A jelenlegi vizsgálatban a kutatók a Ctdnep1, egy foszfatáz (foszfátcsoportokat eltávolító enzim) szerepét vizsgálták, amelyről kimutatták, hogy gátolja a BMP és a TGF-β jelátviteli útvonalakat.
A tanulmány a Biochemical and Biophysical Research Communications folyóiratban jelent meg.
Hayata professzor kijelenti: „A RANKL »gyorsítóként« működik az oszteoklaszt differenciálódás során. Az autóvezetéshez nemcsak gázpedálra, hanem fékre is szükség van. Ebben a tanulmányban azt találtuk, hogy a Ctdnep1 »fékként« működik az oszteoklaszt differenciálódás során.”
A kutatók először a Ctdnep1 expresszióját vizsgálták RANKL-lel kezelt egér makrofágokban és kezeletlen kontrollsejtekben. Megfigyelték, hogy a Ctdnep1 expressziója nem változott a RANKL stimulációra adott válaszként. A makrofágokban azonban szemcsés formában lokalizálódott a citoplazmában, és oszteoklasztokká differenciálódott, ellentétben a többi sejttípusban található normál perinukleáris lokalizációjával, ami a citoplazmában betöltött funkcióját jelzi az oszteoklaszt differenciálódásban.
Továbbá a Ctdnep1 gén leállítása (a génexpresszió csökkentése) a tartarát-rezisztens savas foszfatáz (TRAP) pozitív oszteoklasztok számának növekedéséhez vezetett, ahol a TRAP a differenciált oszteoklasztok markere.
A Ctdnep1 kiütése kulcsfontosságú differenciálódási markerek, köztük az "Nfatc1" fokozott expresszióját eredményezte, amely egy RANKL által indukált mester transzkripciós faktor az oszteoklaszt differenciálódáshoz. Ezek az eredmények alátámasztják a Ctdnep1 "fékező funkcióját", amely negatívan szabályozza az oszteoklaszt differenciálódást. Ezenkívül a Ctdnep1 kiütése a kalcium-foszfát felszívódásának növekedését is eredményezte, ami a Ctdnep1 csontreszorpcióban betöltött szuppresszív szerepére utal.
Végül, bár a Ctdnep1 kiütés nem változtatta meg a BMP és a TGF-β jelátvitelt, a Ctdnep1-hiányos sejtekben megnövekedett mennyiségű foszforilált (aktivált) fehérjét mutattak, amelyek a RANKL jelátviteli útvonal termékei. Ezek az eredmények arra utalnak, hogy a Ctdnep1 gátló hatása az oszteoklaszt differenciálódásra nem feltétlenül a BMP és a TGF-β jelátvitelen keresztül, hanem a RANKL jelátviteli útvonal és az Nfatc1 fehérje szintjének csökkentésén keresztül valósul meg.
Összességében ezek az eredmények új ismereteket nyújtanak az oszteoklaszt differenciálódási folyamatról, és potenciális terápiás célpontokat azonosítanak, amelyek felhasználhatók az oszteoklaszt túlműködés okozta csontvesztés csökkentésére irányuló kezelések fejlesztéséhez. A csontvesztéssel jellemezhető betegségek mellett a Ctdnep1-et a medulloblasztóma, egy gyermekkori agydaganat okozójaként is azonosították. A szerzők optimisták, hogy kutatásaikat kiterjeszthetik más emberi betegségekre is a csontanyagcserén túl.
Hayata professzor így összegzi tanulmányát: „Eredményeink arra utalnak, hogy a Ctdnep1 szükséges a túlzott oszteoklasztogenezis megelőzéséhez. Ezek az eredmények tovább bővíthetik ismereteinket arról, hogy a foszforilációs-defoszforilációs hálózat hogyan szabályozza az oszteoklaszt differenciálódást, és új terápiás stratégiákat kínálhatnak a túlzott oszteoklaszt aktivitással összefüggő csontbetegségek kezelésére.”
