Új kiadványok
Tudósok új immunszuppresszív mechanizmust fedeztek fel az agydaganatban
Utolsó ellenőrzés: 02.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
Filippo Veglia docens Ph.D. és a Wistar Intézet csapata felfedezett egy kulcsfontosságú mechanizmust, amellyel a glioblasztóma – egy súlyos és gyakran halálos kimenetelű agydaganat – elnyomja az immunrendszert, így a daganat a szervezet védekező mechanizmusaitól függetlenül növekedhet.
Felfedezésüket az Immunity folyóiratban megjelent „A glükóz által vezérelt hiszton-laktiláció elősegíti a monocita eredetű makrofágok immunszuppresszív aktivitását a glioblasztómában” című cikkben tették közzé.
„Tanulmányunk azt mutatja, hogy a rák öngerjesztő mechanizmusai, ha kellőképpen megértjük őket, nagyon hatékonyan kihasználhatók a betegség ellen” – mondta Dr. Veglia.
„Várom a glioblasztóma anyagcsere-közvetített immunszuppressziós mechanizmusainak jövőbeli vizsgálatait, és remélem, hogy egyre többet fogunk megtudni arról, hogyan érthetjük meg jobban és küzdhetjük le ezt a rákot.”
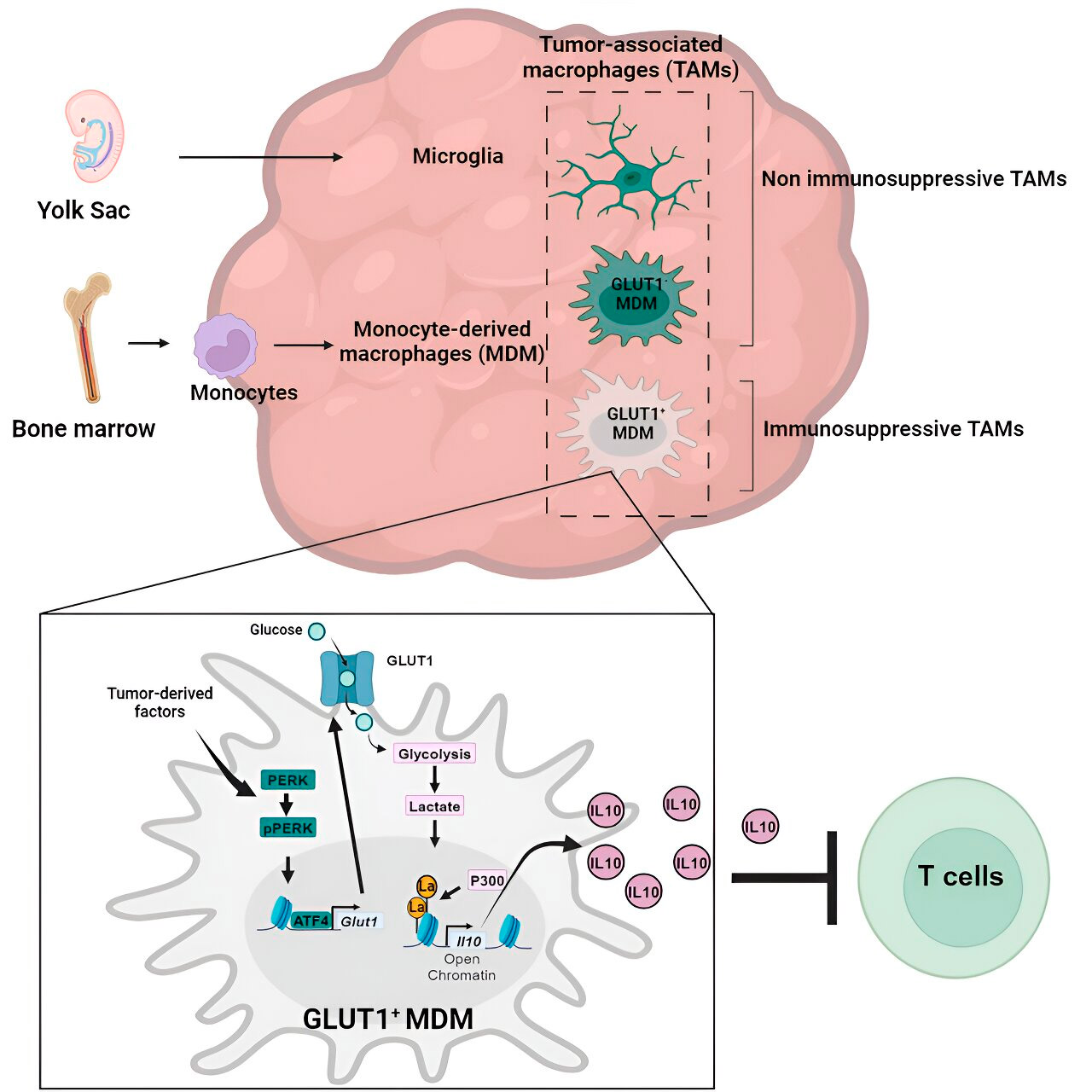
Eddig keveset vizsgáltak arról, hogy a monocita eredetű makrofágok és mikrogliák hogyan hoznak létre immunszuppresszív tumor mikro-környezetet glioblasztómában.
A Veglia laboratórium a glioblasztóma immunszuppressziójának sejtes mechanizmusait vizsgálta, és megállapította, hogy a glioblasztóma előrehaladtával a monocita eredetű makrofágok száma meghaladja a mikrogliaét, ami arra utal, hogy a monocita eredetű makrofágok túlsúlya a tumor mikrokörnyezetében előnyös a rák számára az immunválasz elkerülése szempontjából.
Valóban, a monocita eredetű makrofágok, de nem a mikroglia, blokkolták a T-sejtek (a tumorsejteket elpusztító immunsejtek) aktivitását preklinikai modellekben és betegekben. A kutatócsoport ezt megerősítette a mesterségesen csökkentett számú monocita eredetű makrofággal rendelkező preklinikai glioblasztóma modellek értékelésével.
A várakozásoknak megfelelően a tumor mikrokörnyezetében kevesebb rosszindulatú makrofággal rendelkező modellek jobb eredményeket mutattak a standard glioblasztóma modellekhez képest.
A glioblasztóma az agyban kialakuló összes rosszindulatú daganat valamivel több mint felét teszi ki, és a betegséggel diagnosztizált betegek prognózisa rendkívül rossz: a betegeknek mindössze 25%-a éli túl a diagnózis utáni első évet. A glioblasztóma nemcsak az agyban való elhelyezkedése miatt veszélyes, hanem az immunszuppresszív tumor mikrokörnyezet miatt is, ami rezisztenssé teszi a glioblasztómát az ígéretes immunterápiákkal szemben.
Azzal, hogy bizonyos immunsejteket, például makrofágokat (monocita eredetű makrofágokat és mikrogliákat) programoz, hogy a daganatért dolgozzanak, ne pedig ellene, a glioblasztóma olyan tumor mikrokörnyezetet hoz létre magának, amely lehetővé teszi a rák agresszív növekedését, miközben elkerüli a rákellenes immunválaszokat.
A mechanizmus tisztázása
Miután megerősítették a monocita eredetű makrofágok szerepét, Weglia laboratóriuma megpróbálta megérteni, hogy pontosan hogyan hatnak ezek a rákkal összefüggő immunsejtek az immunrendszer ellen.
Megszekvenálták a makrofágokat, hogy megállapítsák, mutatnak-e a sejtekben olyan rendellenes génexpressziós mintázatokat, amelyek az immunszuppresszióban szerepet játszó génekre utalhatnak, és megvizsgálták a makrofágok anyagcsere-mintázatait is, hogy kiderüljön, az abnormális génexpresszió összefüggésben áll-e az anyagcserével.
Gén- és anyagcsere-elemzés vezette el őket a glükózanyagcseréhez. Egy sor teszt kimutatta, hogy a fokozott glükózanyagcserével és a GLUT1, a glükóz fő transzporterének expressziójával rendelkező monocita eredetű makrofágok interleukin-10 (IL-10) felszabadításával blokkolták a T-sejtek működését.
A csapat kimutatta, hogy a glioblasztóma megzavarja a glükóz anyagcseréjét ezekben a makrofágokban, ami immunszuppresszív aktivitást okoz.
A hiszton laktilációja és szerepe
A kutatók felfedezték, hogy a monocita eredetű makrofágok glükózanyagcserével kapcsolatos immunszuppresszív aktivitásának kulcsa egy „hiszton-laktilációnak” nevezett folyamatban rejlik. A hisztonok a genomban található strukturális fehérjék, amelyek bizonyos kontextusokban kulcsszerepet játszanak olyan gének expressziójában, mint az IL-10.
A glükóz gyors metabolizmusával a monocita eredetű makrofágok laktátot termelnek, amely a glükózanyagcsere mellékterméke. A hisztonok "laktilálódhatnak" (azaz a laktát beépülhet a hisztonokba) oly módon, hogy a hisztonszerveződés elősegíti az IL-10 expresszióját, amelyet a monocita eredetű makrofágok termelnek a ráksejtek növekedésének támogatása érdekében.
Megoldás a problémára
De hogyan lehet megállítani a monocita eredetű makrofágok glükóz-anyagcserével összefüggő immunszuppresszív aktivitását? Dr. Veglia és csapata egy lehetséges megoldást talált: a PERK-et, egy enzimet, amelyet a glükóz-anyagcsere és a GLUT1 makrofágokban való expressziójának szabályozójaként azonosítottak.
A glioblasztóma preklinikai modelljeiben a PERK célzása károsította a hiszton-laktilációt és a makrofágok immunszuppresszív aktivitását, és immunterápiával kombinálva blokkolta a glioblasztóma progresszióját és hosszú távú immunitást indukált, amely megvédte az agyat a daganat újranövekedésétől, ami arra utal, hogy a PERK-hiszton-laktilációs tengely célzása életképes stratégia lehet e halálos agydaganat leküzdésére.
