Új kiadványok
Az ARID1A génmutáció érzékennyé teszi a daganatokat az immunterápiára
Utolsó ellenőrzés: 02.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
Az immunterápia az elmúlt években forradalmasította a rákkezelést. Ahelyett, hogy közvetlenül a daganatokat célozná meg, az immunterápia a betegek immunrendszerét arra irányítja, hogy hatékonyabban támadja meg a daganatokat. Ez különösen hatékony néhány nehezen kezelhető rák esetében. A rákos betegek kevesebb mint fele azonban reagál a jelenlegi immunterápiákra, ami sürgető igényt támaszt olyan biomarkerek azonosítására, amelyek megjósolhatják, hogy mely betegek profitálhatnak a legvalószínűbben a kezelésből.
A tudósok a közelmúltban észrevették, hogy azok a betegek, akiknek a daganatában mutáció van az ARID1A génben, nagyobb valószínűséggel reagálnak pozitívan az immunellenőrzőpont-blokádra, egy olyan immunterápiára, amely a rák ellen küzdő immunsejtek aktivált állapotban tartásával működik.
Mivel az ARID1A génmutáció számos rákos megbetegedésben jelen van, beleértve az endometrium-, petefészek-, vastagbél-, gyomor-, máj- és hasnyálmirigyrákot, a Salk Intézet kutatói azon tűnődtek, hogy ez hogyan járulhat hozzá a kezelés érzékenységéhez, és hogyan használhatják fel a klinikusok ezt az információt a rákkezelés személyre szabásához minden egyes beteg esetében.
Új tanulmányuk, amely a Cell folyóiratban jelent meg, kimutatta, hogy az ARID1A mutáció érzékennyé teszi a tumorokat az immunterápiára azáltal, hogy egy antivirális-szerű immunválasz révén rákellenes immunsejteket toboroz a tumorhoz.
A kutatók azt sugallják, hogy ez a mutáció és az antivirális immunválasz biomarkerként használható a betegek jobb kiválasztására specifikus immunterápiákhoz, például az immunellenőrzőpont-blokádhoz. Ezek az eredmények ösztönzik olyan gyógyszerek fejlesztését is, amelyek az ARID1A-t és a kapcsolódó fehérjéket célozzák meg, hogy más tumorokat érzékenyebbé tegyenek az immunterápiára.
„Ez valóban megváltoztathatja a rákkezelés kimenetelét a betegek számára” – mondta Diana Hargreaves docens, a tanulmány vezető szerzője. „Az ARID1A mutációval rendelkező betegek már rendelkeznek immunválasszal, így mindössze annyit kell tennünk, hogy immunellenőrzőpont-blokáddal fokozzuk ezt a választ, hogy segítsünk nekik belülről elpusztítani a daganataikat.”
Bár ismert volt, hogy az ARID1A mutációval rendelkező emberek jól reagálnak az immunellenőrzőpontok blokkolására, a kettő közötti pontos kapcsolat továbbra sem tisztázott. A mechanizmus megvilágítása érdekében a Salk Intézet tudósai melanoma és vastagbélrák egérmodelleket használtak, amelyekben mind az ARID1A mutáció, mind a funkcionális ARID1A jelen volt.
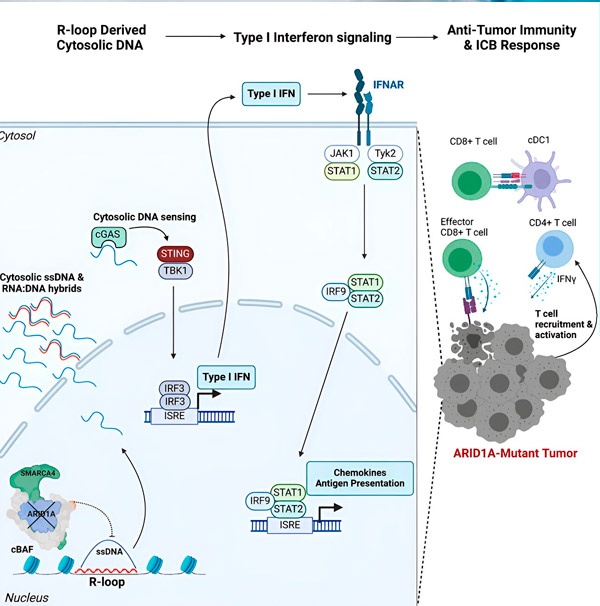
Forrás: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
A csapat az ARID1A mutációt hordozó összes modellben erős immunválaszt figyelt meg, de azokban nem, ahol az ARID1A funkcionális volt, ami alátámasztja azt az elképzelést, hogy az ARID1A mutáció valóban ezt a választ váltja ki. De hogyan működik ez molekuláris szinten?
„Azt találtuk, hogy az ARID1A fontos szerepet játszik a sejtmagban a DNS megfelelő szerveződésének fenntartásával” – mondja Matthew Maxwell, a tanulmány első szerzője és a Hargreaves laboratórium végzős hallgatója. „Működőképes ARID1A nélkül a szabad DNS kivágódhat és a citoszolba szabadulhat fel, aktiválva egy kívánatos vírusellenes immunválaszt, amelyet az immunellenőrző pontok blokádja fokozhat.”
Az ARID1A gén egy olyan fehérjét kódol, amely segít szabályozni a DNS alakját és fenntartani a genom stabilitását. Amikor az ARID1A mutálódik, egy Rube Goldberg-szerű eseményláncolatot indít el a rákos sejtekben.
Először is, a funkcionális ARID1A hiánya DNS felszabadulását eredményezi a citoszolban. A citoszolikus DNS ezután aktivál egy vírusellenes riasztórendszert, a cGAS-STING útvonalat, mivel sejtjeink alkalmazkodtak ahhoz, hogy a citoszolban lévő bármely DNS-t idegenként jelöljenek meg, hogy megvédjék őket a vírusfertőzésektől. Végső soron a cGAS-STING útvonal arra ösztönzi az immunrendszert, hogy T-sejteket toborozzon a tumorhoz, és specializált rákölő T-sejtekké aktiválja azokat.
Minden egyes lépésben, az előzőtől függően, ez az eseménylánc – ARID1A mutáció, DNS-szökés, cGAS-STING riasztás, T-sejtek toborzása – a rák ellen küzdő T-sejtek számának növekedéséhez vezet a tumoron belül. Az immunellenőrzőpontok blokádja ezután biztosíthatja, hogy ezek a T-sejtek aktívak maradjanak, fokozva a rák legyőzésére való képességüket.
„Eredményeink egy új molekuláris mechanizmust mutatnak be, amellyel egy ARID1A mutáció hozzájárulhat egy daganatellenes immunválaszhoz” – mondja Hargreaves. „Ezekben a felfedezésekben a transzlációs potenciál az izgalmas. Az ARID1A mutációk segítségével kiválaszthatjuk a betegeket az immunellenőrzőpont-blokádhoz, és most látunk egy olyan mechanizmust, amellyel az ARID1A-t vagy annak fehérjekomplexét gátló gyógyszerek felhasználhatók más betegek immunterápiájának további fokozására.”
Azzal, hogy leírják azt a mechanizmust, amely révén az immunellenőrzőpontok blokkolása hatékonyabb az ARID1A-mutációval rendelkező rákos megbetegedésekben, a kutatók indokolják a klinikusok számára, hogy miért érdemes ezt az immunterápiát előnyben részesíteni az ARID1A-mutációval rendelkező betegeknél. Ezek az eredmények fontos lépést jelentenek a rákkezelés személyre szabása felé, és inspirálják az ARID1A-t és fehérjekomplexét célzó új terápiák fejlesztését.
A Salk Intézet csapata a jövőben reméli, hogy eredményeik javítani fogják az ARID1A mutációkkal összefüggő különféle rákos megbetegedésekben szenvedő betegek kezelési eredményeit, és a San Diegó-i Kaliforniai Egyetemmel együttműködve tervezi megvizsgálni ezt a klinikai átültetést.
