Új kiadványok
Új genetikai mechanizmusok jelenthetnek terápiás célpontot a glióma ellen
Utolsó ellenőrzés: 02.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
Shi-Yuan Cheng, PhD professzor, a Ken és Ruth Davey Neurológiai Tanszék Neurológiai Onkológiai Osztályának professzora laboratóriumában végzett tanulmány új mechanizmusokat azonosított a glióma tumorsejtek alternatív RNS-splicing eseményei mögött, amelyek új terápiás célpontokként szolgálhatnak. A tanulmány eredményei a Journal of Clinical Investigation című folyóiratban jelentek meg.
„Találtunk egy másik módszert a glioma kezelésére az alternatív splicing lencséjén keresztül, és felfedeztünk új célpontokat, amelyeket korábban nem azonosítottak, de fontosak a glioma rosszindulatú daganatai szempontjából” – mondta Dr. Xiao Song, a neurológia docense és a tanulmány vezető szerzője.
A gliómák a felnőtteknél a leggyakoribb elsődleges agydaganat-típus, és a központi idegrendszerben található és a szomszédos neuronokat támogató gliasejtekből származnak. A gliómák a tumor genetikai és epigenetikai heterogenitása miatt rendkívül rezisztensek a standard kezelésekkel szemben, beleértve a sugárkezelést és a kemoterápiát is, ami rávilágít az új terápiás célpontok megtalálásának szükségességére.
A Cheng laboratórium korábbi, a Cancer Research folyóiratban publikált kutatása kimutatta, hogy a fontos splicing faktor, az SRSF3 szintje jelentősen megemelkedett gliómákban az egészséges agyakhoz képest, és az SRSF3 által szabályozott RNS-splicing a tumorsejtekben több sejtfolyamat befolyásolásával elősegíti a glióma növekedését és progresszióját.
Az RNS-splicing egy olyan folyamat, amely magában foglalja az intronok (az RNS nem kódoló régiói) eltávolítását és az exonok (kódoló régiók) összekapcsolását, hogy egy érett mRNS-molekulát hozzanak létre, amely támogatja a génexpressziót egy sejtben.
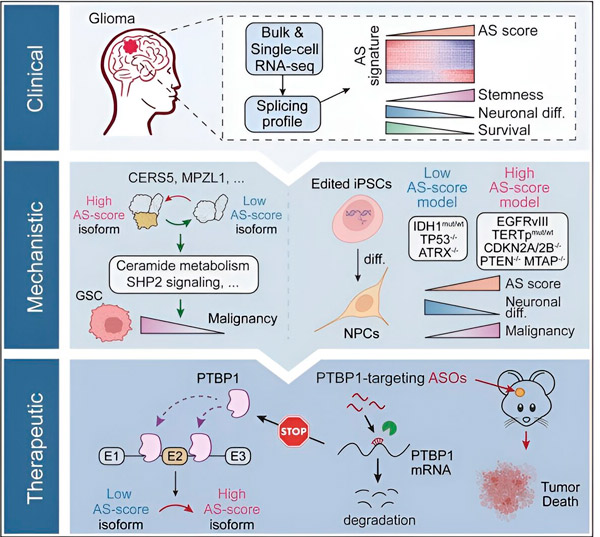
A jelenlegi tanulmányban a tudósok célja a glióma tumorsejtek alternatív splicingjában bekövetkező változások azonosítása, az ezen változások mögött meghúzódó mechanizmusok azonosítása, valamint terápiás célpontként való potenciáljuk meghatározása volt.
Számítógépes módszerek és RNS-szekvenálási technológiák segítségével a kutatók betegmintákból származó glióma tumorsejtek splicing-változásait vizsgálták. Ezen változások megerősítésére CRISPR génszerkesztési technológiákat alkalmaztak, hogy különböző glióma driver mutációkat vigyenek be emberi indukált pluripotens őssejtekből (iPSC-k) származó glióma modellekbe.
Azt találták, hogy ezeket a splicing-változásokat fokozza az epidermális növekedési faktor receptor III (EGFRIII) egy variánsa, amelyről ismert, hogy számos daganatban, köztük gliómákban is túltermelődik, és amelyeket az IDH1 gén mutációja gátol.
A kutatók megerősítették két RNS-splicing esemény funkcióját, amelyek különböző fehérjeizoformákat hoznak létre eltérő aminosav-szekvenciákkal.
„Ezeknek az izoformáknak csak az egyike képes elősegíteni a tumor növekedését, szemben a másik izoformával, amely normális esetben expresszálódik az egészséges agyban. A tumorok ezt a mechanizmust használják ki arra, hogy szelektíven expresszálják a tumort elősegítő izoformát a normális agyi izoformával szemben” – mondta Song.
A csapat ezután elemezte az upstream RNS-kötő fehérjéket, és megállapította, hogy a PTBP1 gén szabályozza a tumort elősegítő RNS-splicingot gliómasejtekben. Immunhiányos egerekben ortotopikus gliómamodellt alkalmazva a kutatók antiszensz oligonukleotid (ASO) alapú terápiával célozták meg a PTBP1-et, ami végső soron elnyomta a tumor növekedését.
„Adataink rávilágítanak az alternatív RNS-splicing szerepére a glioma malignus megbetegedésének és heterogenitásának befolyásolásában, valamint arra, hogy terápiás sebezhetőséget jelenthet a felnőttkori gliómák kezelésében” – írták a tanulmány szerzői.
A kutatók következő lépése a PTBP1 célzásának lehetőségei feltárása daganatellenes immunválasz kiváltására, mondta Song.
„Hosszú leolvasású RNS-szekvenálási analízis segítségével azt találtuk, hogy a PTBP1 gliómasejtekben történő célzása több alternatívan összeillesztett transzkriptum termelődését eredményezi, amelyek a normál szövetekben hiányoznak. Tehát a következő projektünk annak kiderítése, hogy ez az izoforma képes-e olyan antigéneket termelni, amelyek segítségével az immunrendszer jobban felismeri a tumort” – mondta Song.
Song hozzátette azt is, hogy csapatuk a gliómás betegek nem tumorsejtjeinek, például az immunsejteknek a splicing-változásainak elemzésében is érdekelt.
„Már tudjuk, hogy a splicing nagyon fontos a sejtműködés szabályozásában, tehát nemcsak a daganat rosszindulatúságát kellene szabályoznia, hanem az immunsejtek működését is, hogy megállapítsuk, képesek-e hatékonyan elpusztítani a rákot. Ezért bioinformatikai elemzéseket is végzünk a daganatba infiltrált immunsejtekben, hogy lássuk, van-e változás a splicingban, miután egy immunsejt bejutott a daganatba.”
„Célunk az alternatív splicing szerepének meghatározása az immunszuppresszív tumor mikro-környezet alakításában, és a glióma immunterápiáinak hatékonyságának javítására szolgáló potenciális célpontok azonosítása” – mondta Song.
