Új kiadványok
Az FDA által jóváhagyott TIVDAK®: A szöveti faktor célzott kezelése méhnyakrákban
Utolsó ellenőrzés: 02.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
2024. április 29-én az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hatósága (FDA) teljes körű engedélyt adott a Seagen Inc. TIVDAK® (tisotumab vedotin) nevű, szöveti faktor (TF) célzott gyógyszerének, amelyet a kemoterápia alatt vagy után progrediált, kiújuló vagy áttétes méhnyakrákban szenvedő betegek kezelésére alkalmaznak. Ez jelentős áttörést jelent a méhnyakrák-terápiában, rávilágítva az antitest-gyógyszerkonjugátumok (ADC-k) onkológiai potenciáljára.
A TIVDAK hatásmechanizmusa
A Tivdak egy ADC, amely a TF-et célozza meg a Genmab TF-ellenes monoklonális antitestjének, a tisotumabnak a Seagen ADC-technológiájával kombinálva, amelyet úgy terveztek, hogy a TF-antigéneket a rákos sejteken célozza meg, és a citotoxikus MMAE komponenst közvetlenül a rákos sejtekhez juttassa.
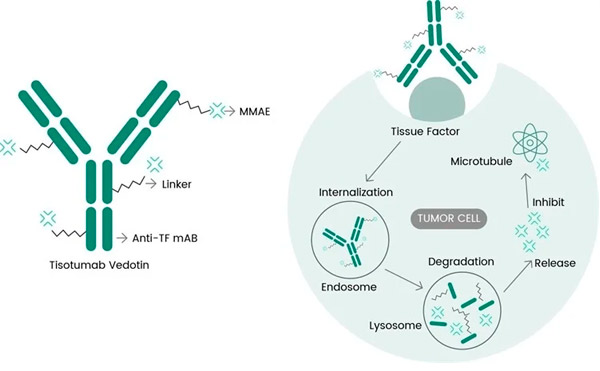
A tisotumab-vedotin molekuláris hatásmechanizmusa ( https://doi.org/10.3390/ijms23073559 )
TF: A tökéletes célpont az ADC fejlesztéséhez
A TF köztudottan részt vesz a tumorjelátvitelben és az angiogenezisben, és a méhnyakrákban és számos más szilárd tumorban szenvedő beteg túlnyomó többségénél túlzott mértékben expresszálódik. Az antitestkötés utáni gyors internalizációs képessége és a normál véralvadásra gyakorolt minimális hatása tovább növeli alkalmasságát a célzott rákterápiára.
