Új kiadványok
A zárt hurkú gyógyszeradagoló rendszer javíthatja a kemoterápia adagolását
Utolsó ellenőrzés: 02.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
Amikor rákos betegek kemoterápiás kezelésen esnek át, a legtöbb gyógyszer adagját a beteg testfelülete alapján számítják ki. Ezt egy olyan egyenlettel becsülik meg, amely figyelembe veszi a beteg magasságát és testsúlyát. Ezt az egyenletet 1916-ban alkották meg, mindössze kilenc beteg adatai alapján.
Ez az egyszerűsített adagolási megközelítés nem vesz figyelembe más tényezőket, és ahhoz vezethet, hogy a beteg túl sok vagy túl kevés gyógyszert kap. Ennek eredményeként egyes betegek szükségtelen toxicitást vagy a kemoterápia elégtelen hatékonyságát tapasztalhatják.
A kemoterápiás adagolás pontosságának javítása érdekében az MIT mérnökei egy alternatív megközelítést fejlesztettek ki, amely lehetővé teszi az adag személyre szabását minden egyes beteg esetében. Rendszerük méri a gyógyszer mennyiségét a beteg szervezetében, és ezeket az adatokat egy vezérlőbe továbbítja, amely ennek megfelelően módosíthatja az infúzió sebességét.
Ez a megközelítés segíthet kompenzálni a gyógyszerfarmakokinetikában mutatkozó különbségeket, amelyeket a testösszetétel, a genetikai hajlam, a kemoterápia által kiváltott szervtoxicitás, a más gyógyszerekkel és élelmiszerekkel való kölcsönhatások, valamint a kemoterápiás gyógyszerek lebontásáért felelős enzimek cirkadián ritmusbeli változásai okoznak – állítják a kutatók.
„Azáltal, hogy felismerjük a gyógyszerek metabolizmusának megértésében elért eredményeket, és mérnöki eszközöket alkalmazunk a személyre szabott adagolás egyszerűsítésére, úgy gondoljuk, hogy segíthetünk számos gyógyszer biztonságosságának és hatékonyságának átalakításában” – mondta Giovanni Traverso, az MIT gépészmérnöki docense, a Brigham and Women's Hospital gasztroenterológusa és a tanulmány vezető szerzője.
Louis DeRidder, az MIT végzős hallgatója a Med folyóiratban megjelent tanulmány vezető szerzője.
Folyamatos monitorozás
Ebben a tanulmányban a kutatók egy 5-fluorouracil nevű gyógyszerre összpontosítottak, amelyetvastagbélrák és más rákos megbetegedések kezelésére használnak. A gyógyszert jellemzően 46 órán keresztül adják be, és az adagját a beteg magassága és súlya alapján meghatározott képlet segítségével határozzák meg, amely a testfelület becslését adja.
Ez a megközelítés azonban nem veszi figyelembe a testösszetételbeli különbségeket, amelyek befolyásolhatják a gyógyszer eloszlását a szervezetben, illetve a genetikai variációkat, amelyek befolyásolják az anyagcseréjét. Ezek a különbségek káros mellékhatásokhoz vezethetnek, ha túl sokat adnak be a gyógyszerből. Ha nem adnak be elegendő gyógyszert, előfordulhat, hogy az nem pusztítja el a daganatot a várt módon.
„Az azonos testfelületű embereknek nagyon eltérő lehet a magasságuk és a testsúlyuk, az izomtömegük vagy a genetikájuk, de amíg a magasság és a testsúly, amelyeket ebbe az egyenletbe illesztünk, ugyanazt a testfelületet eredményezi, addig a dózisuk azonos” – mondja DeRidder, a Harvard-MIT Egészségtudományi és Technológiai Programjának orvosmérnöki és orvosi fizika szakának PhD-jelöltje.
Egy másik tényező, amely bármikor megváltoztathatja a gyógyszer mennyiségét a vérben, a dihidropirimidin-dehidrogenáz (DPD) nevű enzim cirkadián változása, amely lebontja az 5-fluorouracilt. A DPD expresszióját, mint sok más enzimet a szervezetben, egy cirkadián ritmus szabályozza. Így az 5-FU DPD általi lebontása nem állandó, hanem a napszaktól függően változik. Ezek a cirkadián ritmusok az 5-FU mennyiségének tízszeres változását eredményezhetik a beteg vérében egy infúzió során.
„A testfelület felhasználásával a kemoterápiás dózis kiszámításához tudjuk, hogy két embernél nagyon eltérő toxicitás léphet fel az 5-fluorouracil hatására. Az egyik betegnél lehetnek minimális toxicitással járó kezelési ciklusok, majd egy szörnyű toxicitással járó ciklus. Valami megváltozott abban, ahogyan a beteg metabolizálta a kemoterápiát egyik ciklusról a másikra. Az elavult adagolási módszerünk nem veszi figyelembe ezeket a változásokat, és a betegek szenvednek ennek eredményeként” – mondja Douglas Rubinson, a Dana-Farber Rákkutató Intézet klinikai onkológusa és a tanulmány egyik szerzője.
A kemoterápia farmakokinetikájában mutatkozó változékonyság kompenzálására az egyik módszer a terápiás gyógyszermonitorozásnak nevezett stratégia, amelynek során a beteg egy kezelési ciklus végén vérmintát ad. Miután ezt a mintát elemezték a gyógyszerkoncentrációk szempontjából, az adagolás szükség esetén módosítható a következő ciklus elején (általában két hét múlva az 5-fluorouracil esetében).
Ez a megközelítés kimutathatóan jobb eredményekhez vezet a betegeknél, de még nem alkalmazták széles körben kemoterápiás kezelések, például az 5-fluorouracil esetében.
Az MIT kutatói hasonló típusú monitorozást szerettek volna kifejleszteni, de automatizált módon, amely lehetővé tenné a gyógyszeradagolás valós idejű személyre szabását, ami jobb eredményekhez vezethetne a betegek számára.
Zárt hurkú rendszerükben a gyógyszerkoncentrációk folyamatosan monitorozhatók, és ezt az információt felhasználva automatikusan beállítják a kemoterápiás gyógyszer infúziós sebességét, hogy a dózis a céltartományon belül maradjon.
Ez a zárt hurkú rendszer lehetővé teszi a gyógyszeradagolás személyre szabását, figyelembe véve a gyógyszermetabolizáló enzimek szintjének cirkadián ritmusát, valamint a beteg farmakokinetikájában az utolsó kezelés óta bekövetkezett változásokat, például a kemoterápia által kiváltott szervtoxicitást.
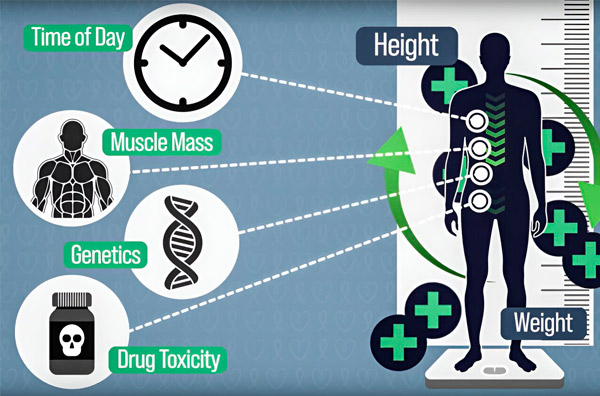
A kemoterápia adagolásának pontosabbá tétele érdekében az MIT mérnökei kifejlesztettek egy módszert, amellyel folyamatosan mérhető a gyógyszer mennyisége a beteg szervezetében egy többórás infúzió során. Ez segít kompenzálni a testösszetétel, a genetika, a gyógyszertoxicitás és a cirkadián ritmus oszcillációi által okozott különbségeket. Forrás: A kutatók jóvoltából.
A kutatók által kifejlesztett új rendszer, a CLAUDIA (Closed-Loop AUtomated Drug Infusion regulAtor) minden lépéshez kereskedelmi forgalomban kapható berendezéseket használ. Ötpercenként vérmintákat vesznek, és gyorsan előkészítik az elemzésre. A vérben lévő 5-fluorouracil koncentrációját mérik, és összehasonlítják a céltartománygal.
A cél- és a mért koncentrációk közötti különbséget egy vezérlő algoritmusba viszik be, amely ezután szükség szerint módosítja az infúziós sebességet, hogy a dózist azon koncentrációtartományon belül tartsa, amelynél a gyógyszer hatékony és nem toxikus.
„Kifejlesztettünk egy olyan rendszert, amellyel folyamatosan mérhetjük a gyógyszerkoncentrációt, és ennek megfelelően állíthatjuk be az infúzió sebességét, hogy a gyógyszerkoncentráció a terápiás ablakon belül maradjon” – mondja DeRidder.
Gyors beállítás
Állatkísérletekben a kutatók azt találták, hogy a CLAUDIA használatával a szervezetben keringő gyógyszer mennyiségét az idő körülbelül 45 százalékában a célzott tartományban tudták tartani.
A CLAUDIA-val nem kezelt kemoterápiás állatok gyógyszerszintje átlagosan csak az idő 13 százalékában maradt a céltartományban. A kutatók ebben a vizsgálatban nem vizsgálták a gyógyszerszintek hatékonyságát, de a koncentrációk célablakban való fenntartása feltehetően jobb eredményeket és kisebb toxicitást eredményez.
A CLAUDIA akkor is képes volt fenntartani az 5-fluorouracil dózisát a céltartományban, amikor egy DPD enzimet gátló gyógyszert adtak be neki. Azoknál az állatoknál, amelyek folyamatos monitorozás és dózismódosítás nélkül kapták ezt az inhibitort, az 5-fluorouracil szintje akár nyolcszorosára is emelkedett.
A demonstrációhoz a kutatók manuálisan, kereskedelmi forgalomban kapható berendezések segítségével végezték el a folyamat minden egyes lépését, de most azt tervezik, hogy automatizálják az egyes lépéseket, hogy a monitorozás és a dózismódosítás emberi beavatkozás nélkül is elvégezhető legyen.
A gyógyszerkoncentrációk mérésére a kutatók nagy teljesítményű folyadékkromatográfia-tömegspektrometriát (HPLC-MS) alkalmaztak, amely technika szinte bármilyen típusú gyógyszer kimutatására alkalmas.
„Egy olyan jövőt látunk, ahol a CLAUDIA-t bármilyen olyan gyógyszer esetében használhatjuk, amely megfelelő farmakokinetikai tulajdonságokkal rendelkezik, és HPLC-MS-sel kimutatható, lehetővé téve a személyre szabott adagolást számos különböző gyógyszer esetében” – mondja DeRidder.
