A cikk orvosi szakértője
Új kiadványok
Súlyos szepszis és szeptikus sokk kezelése
Utolsó ellenőrzés: 04.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
A szepszis hatékony kezelése csak a fertőzés helyének teljes sebészeti szanitációjával és megfelelő antimikrobiális terápiával lehetséges. A nem megfelelő kezdeti antimikrobiális terápia a szepszisben szenvedő betegek halálának kockázati tényezője. A beteg életének fenntartása, a szervkárosodás megelőzése és megszüntetése csak célzott intenzív ellátással lehetséges.
Fő célja az O2- transzport optimalizálása fokozott O2-fogyasztás esetén, ami jellemző a súlyos szepszisre és szeptikus sokkra. Ez a kezelés hemodinamikai és légzéstámogatással valósítható meg.
Hemodinamikai támogatás
Infúziós terápia
Az infúziós terápia az egyik kezdeti intézkedés a hemodinamika és mindenekelőtt a perctérfogat fenntartására. Fő feladatai szepszisben szenvedő betegeknél:
- a megfelelő szöveti perfúzió helyreállítása,
- homeosztázis zavarainak korrekciója,
- a sejtek anyagcseréjének normalizálása,
- a szeptikus kaszkád mediátorainak és a toxikus metabolitok koncentrációjának csökkenése.
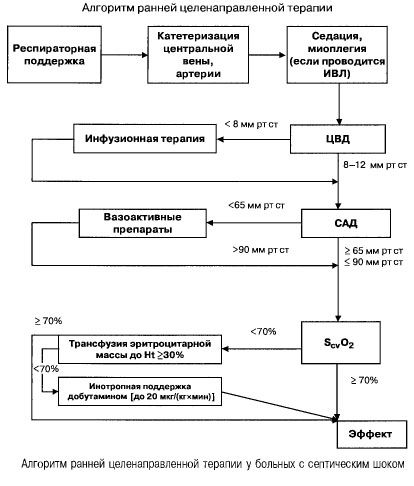
Többszörös szerv elégtelenséggel és szeptikus sokkkal járó szepszis esetén a következő fontos mutatók értékeit próbálják gyorsan (az első 6 órán belül) elérni:
- hematokrit >30%,
- diurézis 0,5 ml/(kg/h),
- a vena cava superiorban vagy a jobb pitvarban a vérszaturáció >70%,
- átlagos vérnyomás > 65 mm Hg,
- CVV 8-12 Hgmm
Ezen értékek meghatározott szinten tartása javítja a betegek túlélését (B bizonyíték kategória). A Swan-Ganz katéterrel és a PICCO technológiával (transzpulmonális termodilúció és pulzushullám-analízis) végzett hemodinamikai monitorozás bővíti a hemodinamikai terápia hatékonyságának monitorozására és értékelésére szolgáló lehetőségeket, de nincs bizonyíték arra, hogy javítanák a túlélést.
Az optimális előterhelési értéket egyénileg választják ki, mivel figyelembe kell venni az endothelkárosodás mértékét és a tüdő nyirokelvezetésének állapotát, a kamrák diasztolés funkcióját és az intrathoracikus nyomás változásait. Az infúziós terápia térfogatát úgy választják meg, hogy a PCWP ne haladja meg a plazma COP-t (OL megelőzése), és a CO növekedjen. Ezenkívül figyelembe veszik a tüdő gázcsere-funkcióját jellemző paramétereket (paO2 és paO2 / FiO2 ) és a radiográfiai kép változásait.
A szepszis és a szeptikus sokk célzott kezelésének részeként infúziós terápiához kristályloid és kolloid oldatokat alkalmaznak gyakorlatilag azonos eredményekkel.
Minden infúziós közegnek vannak előnyei és hátrányai. Ma, a kísérleti és klinikai vizsgálatok eredményei alapján, nincs ok arra, hogy bármelyik típust is előnyben részesítsük.
- Például a vénás visszaáramlás és az előterhelés szintjének megfelelő korrekciójához a krisztalloidok térfogatának 2-4-szerese a kolloidok térfogatának. Ezenkívül a krisztalloid infúzió a szöveti ödéma nagyobb kockázatával jár, és hemodinamikai hatásuk rövidebb, mint a kolloidoké. Ugyanakkor a krisztalloidok olcsóbbak, nem befolyásolják a véralvadási potenciált, és nem provokálnak anafilaktoid reakciókat. A fentiek alapján az infúziós program minőségi összetételét a beteg jellemzőitől függően határozzák meg, figyelembe véve a hipovolémia mértékét, a DIC-szindróma fázisát, a perifériás ödéma jelenlétét és az albumin koncentrációját a vérszérumban, az akut tüdőkárosodás súlyosságát.
- Súlyos basalsejtszám-hiány esetén plazmapótlók (dextránok, zselatinkészítmények, hidroxietil-keményítő) alkalmazása javasolt. A 200/0,5, 130/0,4 és 130/0,42 szubsztitúciós fokú hidroxietil-keményítők potenciális előnyt jelentenek a dextránokkal szemben, mivel kisebb a membránszökés kockázata és nincs klinikailag jelentős hatása a hemosztázisra.
- Kritikus körülmények között az albumin bevezetése növelheti a halálozás kockázatát. Az infúzió során a COP emelkedése átmeneti, majd a kapilláris ágy megnövekedett permeabilitása esetén (a "kapilláris szivárgás" szindróma) az albumin további extravazációja következik be. Lehetséges, hogy az albumin transzfúzió csak akkor lesz hasznos, ha a szérumkoncentrációja kevesebb, mint 20 g/l, és nincsenek jelek az intersticiumba történő "szivárgásra".
- A krioplazma alkalmazása fogyasztási koagulopátia és a vér csökkent koagulációs potenciálja esetén javallt.
- A donor vörösvérsejt-tömeg széles körű alkalmazását korlátozni kell a különféle szövődmények (APL, anafilaxiás reakciók stb.) kialakulásának magas kockázata miatt. A legtöbb szakértő szerint a súlyos szepszisben szenvedő betegek minimális hemoglobin-koncentrációja 90-100 g/l.
Hipotenzió korrekciója
Az alacsony perfúziós nyomás azonnali aktiválását igényli az érrendszeri tónust és/vagy a szív inotrop funkcióját fokozó gyógyszerek esetében. A dopamin vagy a noradrenalin az első vonalbeli gyógyszerek a hipotenzió korrekciójára szeptikus sokkban szenvedő betegeknél.
A dopamin (dopmin) <10 mcg/(kg x perc) dózisban növeli a vérnyomást, elsősorban a szén-dioxid-koncentráció (CO) növelésével, és minimális hatással van a szisztémás érrendszeri ellenállásra. Nagy dózisokban az α-adrenerg hatása dominál, ami artériás érszűkülethez vezet, <5 mcg/(kg x perc) dózisban pedig a dopamin stimulálja a vese-, a mesenterialis és a koszorúér-erek dopaminerg receptorait, ami értágulathoz, fokozott glomeruláris filtrációhoz és Na+ kiválasztáshoz vezet.
A noradrenalin növeli az átlagos artériás nyomást és fokozza a glomeruláris filtrációt. A szisztémás hemodinamika optimalizálása a hatása alatt a vesefunkció javulásához vezet alacsony dopamindózisok alkalmazása nélkül. Az elmúlt évek tanulmányai kimutatták, hogy izolált alkalmazása a nagy dopamindózisokkal kombinált alkalmazáshoz képest statisztikailag szignifikánsan csökkenti a mortalitást.
Az adrenalin egy adrenerg gyógyszer, amelynek a legkifejezettebb hemodinamikai mellékhatásai vannak. Dózisfüggő hatással van a pulzusszámra, az átlagos artériás nyomásra, a perctérfogatra, a bal kamra működésére, valamint az O2-leadásra és -fogyasztásra . Ugyanakkor tachyarrhythmiák, a szervek véráramlásának romlása és hiperlaktatémia jelentkezhet egyidejűleg. Ezért az adrenalin alkalmazása a többi katekolaminra való teljes refrakteritás eseteire korlátozódik.
A dobutamin a választott gyógyszer a CO- és O2-leadás és -fogyasztás fokozására normál vagy emelkedett előterhelés mellett. Mivel elsősorban a béta1-adrenerg receptorokra hat, hatékonyabban növeli ezeket a paramétereket, mint a dopamin.
Kísérleti vizsgálatok kimutatták, hogy a katekolaminok a vérkeringés támogatása mellett a kulcsfontosságú mediátorok szintézisének távoli hatásával befolyásolva szabályozhatják a szisztémás gyulladás lefolyását. Az adrenalin, a dopamin, a noradrenalin és a dobutamin hatására az aktivált makrofágok csökkentik a TNF-α szintézisét és szekrécióját.
Az adrenerg szerek kiválasztását a következő algoritmus szerint végezzük:
- szívindex 3,5-4 l/(perc x m² ), SvO² > 70% - dopamin vagy noradrenalin,
- szívindex <3,5 l/(perc x m2 ), SvO2 < 70% - dobutamin (ha szisztolés vérnyomás <70 mm Hg - noradrenalinnal vagy dopaminnal együtt).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
Légzéstámogatás
A tüdő a szepszis kóros folyamatában az elsők között érintett célszervek közé tartozik. Az akut légzési elégtelenség a többszervi diszfunkció egyik vezető összetevője. Klinikai és laboratóriumi tünetei szepszisben megfelelnek az ALI-nak, és a kóros folyamat előrehaladtával az ARDS-nek. A súlyos szepszisben a gépi lélegeztetés indikációit a parenchymás légzési elégtelenség (ARF vagy ARDS) súlyossága alapján határozzák meg. Kritériuma a légzési index:
- <200 - tracheális intubáció és légzéstámogatás szükséges,
- >200 – a leolvasásokat egyénileg határozzák meg.
Ha a beteg spontán oxigénellátás melletti légzés közben eszméleténél van, a légzési munka nem igényel nagy erőfeszítést, és nincs kifejezett tachycardia (pulzusszám <120 percenként), a vénás visszaáramlás normál értéke pedig >90%, akkor el lehet tekinteni a mesterséges lélegeztetéstől. Azonban a beteg állapotának gondos megfigyelése szükséges. Az SO2 optimális értéke körülbelül90 %. Különböző gázadagolási módszerekkel (arcmaszkok, orrkatéterek) fenntartható nem toxikus koncentrációban (FiO2 < 0,6). A nem invazív mesterséges lélegeztetés ellenjavallt szepszisben (B bizonyíték kategória).
Kerülni kell a nagy térfogatú mechanikus lélegeztetési (MVV) módokat (VO2 = 12 ml/kg), mivel ilyen esetekben a tüdő citokinszekréciója fokozódik, ami a MOF súlyosbodásához vezet. Szükséges a biztonságos mechanikus lélegeztetés koncepciójának betartása, amely a következő feltételek teljesülése esetén lehetséges (A bizonyíték kategória):
- DO <10 ml/kg,
- a belégzés és kilégzés nem fordított aránya,
- csúcs légúti nyomás <35 cm H2O,
- FiO2 <0,6 .
A légzési ciklus paramétereinek kiválasztását a megfelelő mechanikus lélegeztetés eléréséig végzik, kritériumai: paO2 > 60 Hgmm, SpO2 > 88-93%, pvO2 35-45 Hgmm, SvO2 > 55%.
A gázcsere optimalizálásának egyik hatékony módszere a mesterséges lélegeztetés hason fekvő helyzetben (Prone Positioning) (B bizonyíték kategória). Ez a pozíció a legsúlyosabb állapotú betegeknél is hatékony, bár a hosszú távú mortalitáscsökkentésre gyakorolt hatása statisztikailag nem szignifikáns.
Táplálkozási támogatás
A mesterséges táplálás fontos eleme a kezelésnek, az egyik kötelező intézkedés, mivel a szepszisben a többszörös szerv elégtelenség szindrómájának kialakulása általában hipermetabolizmus megnyilvánulásaival jár. Ilyen helyzetben az energiaigényt a saját sejtszerkezetek pusztulásával (autokannibalizmus) elégítik ki, ami súlyosbítja a szervkárosodást és fokozza az endotoxikózist.
A táplálkozási támogatást a súlyos kimerültség (fehérje-energiahiány) megelőzésének egyik módszerének tekintik a kata- és anyagcsere-folyamatok kifejezett növekedésének hátterében. Az enterális táplálás intenzív terápia komplexébe való beillesztése megakadályozza a bélflóra mozgását, a diszbakteriózist, növeli az enterociták funkcionális aktivitását és a bélnyálkahártya védő tulajdonságait. Ezek a tényezők csökkentik az endotoxikózis mértékét és a másodlagos fertőző szövődmények kockázatát.
A tápanyag-támogatás kiszámítása:
- energiaérték - 25-35 kcal/(testtömeg-kg x nap),
- fehérjemennyiség - 1,3-2,0 g/(testtömeg-kg x nap),
- szénhidrátok (glükóz) mennyisége - kevesebb, mint 6 g/kg/nap,
- zsírmennyiség - 0,5-1 g/kg/nap,
- glutamin-dipeptidek 0,3-0,4 g/kg/nap,
- vitaminok - standard napi adag + K-vitamin (10 mg/nap) + B1- és B6 vitamin (100 mg/nap) + A-, C-, E-vitamin,
- mikroelemek - standard napi adag + Zn (15-20 mg/nap + 10 mg/nap híg széklet esetén),
- elektrolitok - Na+, K+, Ca2+ az egyensúlyi számítások és a plazmakoncentráció szerint.
A táplálási támogatás korai megkezdése (24-36 óra) hatékonyabb, mint az intenzív terápia 3-4. napján (B bizonyíték kategória), különösen enterális szondatáplálás esetén.
Súlyos szepszis esetén az enterális vagy parenterális táplálásnak nincsenek előnyei; a szervkárosodás, a légzési és inotrop támogatás időtartama azonos, és a halálozási arányok is azonosak. A fentiek alapján a korai enterális táplálás olcsóbb alternatíva a parenterális tápláláshoz képest. Az élelmi rostokkal (prebiotikumokkal) dúsított keverékek alkalmazása szondatápláláshoz jelentősen csökkenti a hasmenés előfordulását súlyos szepszisben szenvedő betegeknél.
A szervezet hatékony fehérjeszintéziséhez fontos fenntartani az "összes nitrogén, g - nem fehérje kalória, kcal" = 1-(110-130) metabolikus arányt. A szénhidrátok maximális adagja 6 g / (testtömeg-kg naponta), mivel a nagy dózisok bevezetése veszélyezteti a hiperglikémiát és a vázizmok katabolizmusának aktiválódását. A zsíremulziók adagolása ajánlott a nap 24 órájában.
Ellenjavallatok a táplálékkiegészítőkhöz:
- dekompenzált metabolikus acidózis,
- egyéni intolerancia a táplálékkiegészítőkre,
- súlyos, nem gyógyuló hipovolémia,
- refrakter sokk - dopamin dózis >15 mcg/(kg x perc) és szisztolés vérnyomás <90 mm Hg,
- súlyos, kezelhetetlen artériás hipoxémia.
Glikémiás kontroll
A súlyos szepszis komplex kezelésének fontos aspektusa a vérplazma glükózkoncentrációjának folyamatos monitorozása és az inzulinterápia. A magas vércukorszint és annak korrekciójának szükségessége a szepszis kedvezőtlen kimenetelének tényezői. A fenti körülmények miatt a betegeknél normoglikémia (4,5-6,1 mmol/l) marad, amelyhez, amikor a glükózkoncentráció az elfogadható értékek fölé emelkedik, inzulin infúziót (0,5-1 U/h) végeznek. A klinikai helyzettől függően a glükózkoncentrációt 1-4 óránként monitorozzák. Ennek az algoritmusnak a bevezetésekor a betegek túlélésének statisztikailag szignifikáns növekedését figyelték meg.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
Glükokortikoidok
A glükokortikoidok szeptikus sokkban szenvedő betegeknél történő alkalmazásának hatékonyságára vonatkozó modern vizsgálatok eredményeit a következő állításokban foglaljuk össze:
- Nem helyénvaló nagy dózisú hormonokat alkalmazni [metilprednizolon 30-120 mg/(kg x nap) egyszer vagy 9 napig, dexametazon 2 mg/(kg x nap) 2 napig, betametazon 1 mg/(kg x nap) 3 napig] - fokozott a kórházi fertőzések kockázata, nincs hatással a túlélésre,
- A hidrokortizon napi 240-300 mg-os dózisban, 5-7 napig történő alkalmazása felgyorsítja a hemodinamikai paraméterek stabilizálódását, lehetővé teszi az érrendszeri támogatás visszavonását és javítja a túlélést egyidejűleg relatív mellékvese-elégtelenségben szenvedő betegeknél (B bizonyítékkategória).
Szükséges elhagyni a prednizolon és a dexametazon kaotikus empirikus felírását - nincs ok az új információk extrapolálására rájuk. A relatív mellékvese-elégtelenség laboratóriumi bizonyítékainak hiányában napi 300 mg-os hidrokortizont (3-6 injekcióban) adnak be.
- refrakter sokk esetén,
- ha a hatékony hemodinamika fenntartásához nagy dózisú vazopresszorokra van szükség.
Lehetséges, hogy szeptikus sokk esetén a szisztémás gyulladásos állapotokban a hidrokortizon hatékonysága a nukleáris faktor kB inhibitor (NF-kB-α) aktiválódásával és a relatív mellékvese-elégtelenség korrekciójával jár. A transzkripciós nukleáris faktor (NF-kB) aktivitásának gátlása viszont az indukálható NO-szintetáz (a NO a legerősebb endogén értágító), a gyulladáskeltő citokinek, a COX és az adhéziós molekulák képződésének csökkenéséhez vezet.
Aktivált C-protein
A szepszis egyik jellegzetes megnyilvánulása a szisztémás koaguláció zavara (a koagulációs kaszkád aktiválódása és a fibrinolízis gátlása), ami végső soron hipoperfúzióhoz és szervkárosodáshoz vezet. Az aktivált C protein gyulladásos rendszerre gyakorolt hatása többféleképpen is megvalósul:
- a szelektin leukocitákhoz való kötődésének csökkentése, ami megvédi az endotéliumot a károsodástól, és kulcsszerepet játszik a szisztémás gyulladás kialakulásában,
- csökkent citokinfelszabadulás monocitákból,
- blokkolja a TNF-α felszabadulását a leukocitákból,
- a trombin termelésének gátlása (fokozza a gyulladásos választ).
Antikoaguláns, profibrinolitikus és gyulladáscsökkentő hatás
- Az aktivált C protein a következőknek köszönhető:
- Va és VIIIa faktorok lebomlása - trombusképződés gátlása,
- plazminogén aktivátor inhibitor elnyomása - fibrinolízis aktiválása,
- közvetlen gyulladáscsökkentő hatás az endothelsejtekre és a neutrofilekre,
- az endotélium védelme az apoptózistól
Az aktivált protein C [aktivált alfa drotrekogin] 24 mcg/(kg/h) dózisban 96 órán keresztül történő adagolása 19,4%-kal csökkenti a halálozás kockázatát. Az alkalmazás indikációi: akut MOF-fel járó szepszis, magas halálozási kockázattal (APACHE II > 25 pont, 2 vagy több szerv diszfunkciója, B bizonyítékkategória).
Az aktivált C-protein nem csökkenti a mortalitást gyermekeknél, egyszervi diszfunkcióban szenvedő betegeknél, APACHE II < 25 pontban szenvedő betegeknél, nem sebészeti szepszisben szenvedő betegeknél.
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Immunglobulinok
Az immunglobulinok (IgG és IgG+IgM) intravénás adagolásának célszerűsége összefügg azzal a képességükkel, hogy korlátozzák a gyulladáskeltő citokinek túlzott hatását, növelik az endotoxinok és a staphylococcus szuperantigén clearance-ét, megszüntetik az anergiát és fokozzák a ß-laktám antibiotikumok hatását. Alkalmazásuk súlyos szepszis és szeptikus sokk kezelésében az egyetlen olyan immunkorrekciós módszer, amely növeli a túlélést. A legjobb hatást IgG és IgM kombinációjának alkalmazásakor regisztrálták [RR = 0,48 (0,35-0,75), A bizonyíték kategória]. A standard adagolási rend 3-5 ml/(kg x nap) 3 egymást követő napon. Immunoglobulinok alkalmazásakor a legoptimálisabb eredményeket a sokk korai fázisában ("meleg sokk") és súlyos szepszisben szenvedő betegeknél (APACHE II pontszám 20-25 pont) érték el.
A mélyvénás trombózis megelőzése
Az alsó végtagi mélyvénás trombózis megelőzése jelentősen befolyásolja a szepszisben szenvedő betegek kezelésének eredményeit (A bizonyíték kategória). Erre a célra mind a frakcionálatlan, mind az LMWH-t alkalmazzák. Az alacsony molekulatömegű heparinok fő előnyei a vérzéses szövődmények alacsonyabb előfordulása, a vérlemezke-funkcióra gyakorolt gyengébb hatás és a tartós hatás (naponta egyszer adható).
A gyomor-bélrendszeri stresszfekélyek kialakulásának megelőzése
Ez az irány jelentős szerepet játszik a súlyos szepszisben és szeptikus sokkban szenvedő betegek kezelésének kedvező kimenetelében, mivel a gyomor-bél traktus stresszfekélyeiből eredő vérzés halálozási aránya 64-87%. Megelőző intézkedések nélkül a kritikus állapotú betegek 52,8%-ánál fordul elő stresszfekély. A protonpumpa-gátlók és a hisztamin H2-receptor-blokkolók alkalmazása azonban több mint kétszeresére csökkenti a kockázatot (az első gyógyszercsoport hatékonyabb, mint a második). A megelőzés és a kezelés fő iránya a pH 3,5-6,0 közötti értéken tartása. Hangsúlyozni kell, hogy a fenti gyógyszerek mellett az enterális táplálás is fontos szerepet játszik a stresszfekélyek kialakulásának megelőzésében.
Extrakorporális vértisztítás
A generalizált gyulladás kialakulásában részt vevő különféle biológiailag aktív anyagok és anyagcsere-termékek a méregtelenítő módszerek célpontjai, ami különösen fontos a természetes hepatorenális clearance hiányában több szerv elégtelenségében. A vesepótló terápiás módszerek ígéretesnek tekinthetők, mivel nemcsak a veseelégtelenségben szenvedő betegek urémiás rendellenességeire tudnak hatással lenni, hanem pozitív hatással vannak a homeosztázis egyéb változásaira és a szervi diszfunkciókra is, amelyek szepszis, sokk és több szerv elégtelenség esetén jelentkeznek.
A mai napig nincsenek olyan adatok, amelyek megerősítenék az extrakorporális vértisztítási módszerek alkalmazásának szükségességét a szepszis és a szeptikus sokk patogenetikai terápiájának egyik fő irányaként. Alkalmazásuk vese dominanciájú többszörös szervelégtelenség esetén indokolt.
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
Hemodialízis
A módszer lényege a kis molekulatömegű (akár 5x103 Da) anyagok féligáteresztő membránon keresztüli diffúziója és a felesleges folyadék eltávolítása a szervezetből nyomásgradiens mentén. A hemodialízist széles körben alkalmazzák mind krónikus, mind akut veseelégtelenségben szenvedő betegek kezelésére. Az anyagok diffúziójának sebessége exponenciálisan függ molekulatömegüktől. Például az oligopeptidek eltávolítása lassabb, mint szintézisük.
Hemofiltráció
A hemofiltráció hatékony módszer az 5x103 - 5x104 Da molekulatömegű anyagok eltávolítására, és az egyetlen módja annak, hogy a szervezetből nagyszámú biológiailag aktív anyagot és metabolitot távolítsunk el. A módszer a tömegátadás konvekciós módszerén alapul. Az azotémia megfelelő korrekciója mellett a hemofiltráció hatékonyan eltávolítja az anafilatoxinokat C3a, C5a, a gyulladáskeltő citokineket (TNF-α, IL-1b, 6 és 8), a ß2-mikroglobulint, a mioglobint, a parathormont, a lizozimet (molekulatömeg - 6000 Da), az α-amilázt (molekulatömeg - 36 000-51 000 Da), a kreatin-foszfokinázt, az alkalikus foszfatázt, a transzaminázokat és más anyagokat. A hemofiltráció eltávolítja az aminosavakat és a plazmafehérjéket (beleértve az immunglobulinokat és a keringő immunkomplexeket).
Hemodiafiltráció
A hemodiafiltráció a vértisztítás leghatékonyabb módszere, amely a diffúziót és a konvekciót (azaz a GD-t és a GF-et) ötvözi. A méregtelenítési folyamathoz további hozzájárulást jelent a kóros anyagok szorpciója a szűrőmembránon.
Plazmaferézis
A plazmaferézist (plazmacsere, plazmafiltráció) szintén lehetséges módszernek tekintik a generalizált gyulladás korrekciójára szepszisben és szeptikus sokkban szenvedő betegeknél. Az optimális módszernek a plazmacsere folyamatos üzemmódban történő alkalmazása tekinthető 3-5 térfogatnyi plazma eltávolításával és egyidejű pótlásával frissen fagyasztott albumin, kolloid és krisztalloid oldatokkal. 1-es szitálási együtthatóval a plazmafiltráció biztosítja a C-reaktív protein, a haptoglobin, a C3 komplement fragmens, az 1-antitripszin, az IL-6, a tromboxán-B2, a granulocita-stimuláló faktor és a TNF jó eltávolítását. A szorbensek használata a beteg plazma tisztítására csökkenti a fertőzés kockázatát és csökkenti az eljárás költségeit, mivel nincs szükség idegen fehérjék használatára.
Súlyos szepszisben a nátrium-szelenit (szelenáz) 1000 mcg/nap dózisú, hosszan tartó infúziójának alkalmazása a mortalitás csökkenéséhez vezet.
A szelén egy esszenciális mikroelem, amelynek fontossága a sejtek antioxidáns rendszerében betöltött kulcsszerepével függ össze. A vér szelénszintje 1,9-3,17 μM/l között van. A szelénszükséglet napi 50-200 μg, és ez más antioxidánsok és mikroelemek elérhetőségétől függ.
A szelén egy erős antioxidáns, a glutation-peroxidáz, a foszfolin-glutation-peroxidáz, más oxidoreduktázok és néhány transzferáz alkotóeleme. A glutation-peroxidáz a legfontosabb láncszem az endogén antioxidáns rendszerben.
A szelén hatékonyságát kritikus állapotokban az elmúlt években vizsgálták. Ezek a tanulmányok kimutatták, hogy a szelén fő hatásmechanizmusai a következők:
- az NF-kB hiperaktivációjának elnyomása;
- csökkent komplement aktiváció;
- immunmoduláló, antioxidáns és gyulladáscsökkentő hatású
- a peroxid felhasználásának fenntartása;
- az endoteliális adhézió elnyomása (az ICAM-1, VCAM-2 csökkent expressziója,
- E - szelektin, P - szelektin);
- az endotélium védelme az oxigyököktől (szelenoprotein P segítségével, amely megakadályozza a peroxinitrit képződését O2-ből és NO-ból).
A fentiek összefoglalásaként meghatározhatjuk a súlyos szepszis intenzív osztályának konkrét feladatait:
- Hemodinamikai támogatás: szívizomnyomás 8-12 mm Hg, átlagos vérnyomás >65 mm Hg, diurézis 0,5 ml/(kg/óra), hematokrit >30%, kevert vénás vér szaturáció >70%.
- Légzéstámogatás csúcs légúti nyomása <35 cm H2O, belégzési oxigénfrakció <60%, légzési térfogat <10 ml/kg, nem invertált belégzési-kilégzési arány.
- Glükokortikoidok - "alacsony dózisok" (hidrokortizon 240-300 mg naponta).
- Aktivált protein C 24 mcg/(kg/óra) 4 napig súlyos szepszisben (APACHE II >25).
- Immunkorrekciós helyettesítő terápia pentaglobinnal.
- Az alsó végtagok mélyvénás trombózisának megelőzése.
- A gyomor-bél traktus stresszfekélyeinek kialakulásának megelőzése: protonpumpa-gátlók és H2-hisztamin receptor blokkolók alkalmazása.
- Akut veseelégtelenség helyettesítő terápiája.
- Táplálkozási támogatás: az élelmiszerek energiaértéke 25-30 kcal/testtömeg-kg x nap), fehérje 1,3-2,0 g/(testtömeg-kg x nap), glutamin-dipeptidek 0,3-0,4 g/(kg x nap), glükóz - a nem fehérje kalóriák 30-70%-a, feltéve, hogy a glikémiát <6,1 mmol/l értéken tartják, zsírok - a nem fehérje kalóriák 15-50%-a.

