A cikk orvosi szakértője
Új kiadványok
Emberi immunhiány vírus (HIV)
Utolsó ellenőrzés: 04.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
A szerzett immunhiányos szindrómát (Acquired Immune Deficiency Syndrome) 1981-ben azonosították specifikus betegségként az Egyesült Államokban, amikor számos fiatalnál súlyos betegség alakult ki, amelyeket az egészséges emberek számára nem patogén vagy gyengén patogén mikroorganizmusok okoztak. A betegek immunstátuszának vizsgálata a limfociták, különösen a T-helperek számának hirtelen csökkenését mutatta ki. Ezt az állapotot AIDS-nek (Acquired Immune Deficiency Syndrome) nevezték el. A fertőzés módja (szexuális kapcsolat, vér és annak készítményei útján) a betegség fertőző jellegére utalt.
Az AIDS kórokozóját 1983-ban fedezte fel függetlenül a francia L. Montagnier, aki LAV limfoadenopátiával összefüggő vírusnak nevezte el, mivel egy limfadenopátiás betegben találta meg; és az amerikai R. Gallo, aki HTLV-III-nak (Human T-limfotropikus vírus III) nevezte el a vírust: korábban ő fedezte fel az I. és II. limfotropikus vírust.
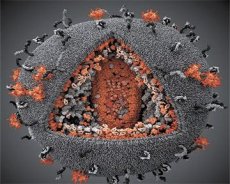
A LAV és a HTLV-III vírusok tulajdonságainak összehasonlítása kimutatta azonosságukat, így a félreértések elkerülése végett a vírust 1986-ban HIV-nek (Human Immunodeficiency Virus, vagy HIV) nevezték el. A HIV gömb alakú, 110 nm átmérőjű. A vírusburok poliéder alakú, 12 ötszögből és 20 hatszögből áll. Mindegyik hatszög közepén és sarkaiban egy glikozilált gpl20 fehérje molekula található (a 120-as szám a fehérje molekulatömegét jelzi kilodaltonban). Összesen 72 gpl20 molekula található a virion felszínén sajátos tüskék formájában, amelyek mindegyike a gp41 intramembrán fehérjéhez kapcsolódik. Ezek a fehérjék a kettős lipidréteggel együtt alkotják a virion szuperkapszidját (membránját).
A gpl20 és gp41 fehérjék az Env prekurzor fehérje sejtes proteáz általi hasításával képződnek. A gp41 fehérje citoplazmatikus doménjével a közvetlenül a burok alatt található p17MA mátrixfehérjéhez kötődve alkotja a tüske "szárát". A p17 molekulák a virion érése során kölcsönhatásba lépnek, és egy ikozaédert alkotnak a burok alatt.
A virion központi részében a p24 fehérje kúp alakú kapszidot alkot. A kapszid szűkült része az rb fehérje részvételével kapcsolódik a virion membránjához. A kapszid belsejében két azonos vírus genomiális RNS-molekula található. Ezek 5'-végükkel kapcsolódnak a p7NC nukleokapszid fehérjéhez. Ez a fehérje azért érdekes, mert két ciszteinben és hisztidinben gazdag aminosavmaradékkal (motívummal) rendelkezik, amelyek egy Zn-atomot tartalmaznak - ezeket "cink-ujjaknak" nevezik, mert a genomiális RNS molekuláit fogják be a képződő virionokba. A kapszid három enzimet is tartalmaz. A revertáz (RT), vagy pol komplex, magában foglalja a reverz transzkriptázt, az RNáz H-t és a DNS-függő DNS-polimerázt. A revertáz heterodimerként, p66/p51 formában van jelen. A proteáz (PR) - p10, a virion érési folyamatát indítja el és hajtja végre. Az integráz (IN) - p31, vagy endonukleáz, biztosítja a provirális DNS beépülését a gazdasejt genomjába. A kapszid egy primer RNS molekulát (tRNAl"3) is tartalmaz.
A sejtben lévő RNS-genom reverz transzkriptáz segítségével DNS-genommá (DNS-provírussá) alakul, amely 9283 nukleotidpárból áll. Balról és jobbról úgynevezett hosszú terminális ismétlődések, vagy LTR-ek határolják: balról S'-LTR, jobbról pedig 3'-LTR. Az LTR-ek egyenként 638 nukleotidpárt tartalmaznak.
A HIV genom 9 génből áll, amelyek közül néhány átfedésben van a végein (több leolvasási kerettel rendelkezik) és exonintron szerkezettel rendelkezik. 9 strukturális és 6 szabályozó fehérje szintézisét szabályozzák.
Az LTR-ek fontossága a vírusgenom szempontjából az, hogy a következő szabályozó elemeket tartalmazzák, amelyek szabályozzák annak működését:
- transzkripciós jel (promóter régió);
- poli-A addíciós jel;
- lezáró jel;
- integrációs jel;
- pozitív szabályozási jel (TAR a TAT fehérjéhez);
- negatív szabályozó elem (NRE a NEF fehérjéhez);
- egy hely a primer RNS (tRNA™3) kapcsolódásához a mínusz szálú DNS szintéziséhez a 3' végén; egy jel az LTR 5' végén, amely primerként szolgál a plusz szálú DNS szintéziséhez.
Ezenkívül az LTR olyan elemeket tartalmaz, amelyek részt vesznek az mRNS splicing szabályozásában, a vRNS-molekulák kapszidba csomagolásában (Psi elem). Végül, a genom transzkripciója során két jel alakul ki a REV fehérje hosszú mRNS-eiben, amelyek a fehérjeszintézist kapcsolják: a CAR - a szabályozó fehérjékhez és a CRS - a strukturális fehérjékhez. Ha a REV fehérje a CAR-hoz kötődik, strukturális fehérjék szintetizálódnak; ha az hiányzik, akkor csak szabályozó fehérjék szintetizálódnak.
A következő szabályozó gének és fehérjéik különösen fontos szerepet játszanak a vírusgenom működésének szabályozásában:
- TAT fehérje, amely pozitív kontrollt végez a vírusreplikáció felett, és a TAR szabályozó régión keresztül hat;
- NEV és VPU fehérjék, amelyek negatív kontrollt gyakorolnak a replikációra az NRE régión keresztül;
- REV fehérje, amely pozitív-negatív kontrollt végez. A REV fehérje a gag, pol és env gének működését szabályozza, és a splicing negatív szabályozását végzi.
Így a HIV replikációja hármas kontroll alatt áll - pozitív, negatív és pozitív-negatív.
A VIF fehérje határozza meg az újonnan szintetizált vírus fertőzőképességét. A p24 kapszidfehérjéhez kapcsolódik, és 60 molekula mennyiségben van jelen a virionban. A NEF fehérjét a virionban kis számú molekula (5-10) képviseli, valószínűleg a vírusburokhoz kapcsolódóan.
A VPR fehérje gátolja a sejtciklust a G2 fázisban, részt vesz a preintegrációs komplexek sejtmagba történő transzportjában, aktivál néhány vírusos és sejtes gént, és növeli a vírusreplikáció hatékonyságát monocitákban és makrofágokban. A VPR, TAT, REV és VPU fehérjék helye a virionban még nem tisztázott.
A saját fehérjéi mellett a virion membrán tartalmazhat a gazdasejt néhány fehérjéjét is. A VPU és VPR fehérjék részt vesznek a vírusszaporodás szabályozásában.
A humán immunhiányos vírus (HIV) antigén variánsai
Az emberi immunhiány vírusa (HIV) nagyon változékony. Már egyetlen beteg testéből is izolálhatók olyan vírustörzsek, amelyek antigén tulajdonságaikban jelentősen eltérnek. Ezt a változékonyságot a CD4+ sejtek intenzív pusztulása és a HIV-fertőzéssel szembeni erős antitestválasz segíti elő. Nyugat-afrikai betegekből izoláltak egy új HIV-formát, a HIV-2-t, amely biológiailag közel áll a HIV-1-hez, de immunológiailag eltér tőle. Ezen vírusok genomjának elsődleges szerkezetének homológiája 42%. A HIV-2 DNS-provírusa 9671 bp-t, LTR-je pedig 854 bp-t tartalmaz. A HIV-2-t ezt követően a világ más régióiban is izolálták. A HIV-1 és a HIV-2 között nincs keresztimmunitás. A HIV-1 két fő formája ismert: az O (kiugró) és az M (jelentős), ez utóbbi 10 altípusra (AJ) oszlik. Oroszországban nyolc altípus (AH) kering.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
A HIV és a sejt közötti kölcsönhatás mechanizmusa
Miután bejutott a szervezetbe, a vírus először a rá jellemző CD4-receptort tartalmazó sejteket támadja meg. Ez a receptor nagy mennyiségben van jelen a T-helperekben, kisebb mennyiségben a makrofágokban és a monocitákban, és a T-helperek különösen érzékenyek a vírusra.
Az emberi immunhiányos vírus (HIV) a gpl20 fehérjéje segítségével ismeri fel a CD4 receptorokat. A HIV és a sejt közötti kölcsönhatás folyamata a következő séma szerint zajlik: receptor-közvetített adszorpció -> bevonatos gödör -> bevonatos vezikula -> lizoszóma. Ebben a virion membrán egyesül a lizoszóma membránjával, és a szuperkapszidból felszabaduló nukleokapszid a citoplazmába jut; a sejtmag felé vezető úton elpusztul, és a genomiális RNS és a hozzá tartozó magkomponensek felszabadulnak. Ezután a reverz transzkriptáz szintetizálja a virion RNS-en lévő DNS mínusz szálát, majd az RNáz H lebontja a virion RNS-t, és a vírus DNS polimeráz szintetizálja a DNS plusz szálát. A DNS provírus végein 5'-LTR és 3'-LTR alakul ki. A DNS provírus egy ideig inaktív formában maradhat a sejtmagban, de előbb-utóbb integráza segítségével beépül a célsejt kromoszómájába. Ebben a provírus inaktív marad, amíg az adott T-limfocitát mikrobiális antigének vagy más immunkompetens sejtek nem aktiválják. A sejtes DNS-transzkripció aktiválódását egy speciális nukleáris faktor (NF-kB) szabályozza. Ez egy DNS-kötő fehérje, és nagy mennyiségben termelődik a T-limfociták és monociták aktiválódása és proliferációja során. Ez a fehérje a sejtes DNS bizonyos szekvenciáihoz és a DNS-provírus hasonló LTR-szekvenciáihoz kötődik, és mind a sejtes DNS, mind a DNS-provírus transzkripcióját indukálja. A DNS-provírus transzkripciójának indukálásával végrehajtja a vírus inaktív állapotból aktív állapotba, és ennek megfelelően a perzisztens fertőzött állapotból produktív állapotba való átmenetét. A provírus nagyon hosszú ideig inaktív állapotban maradhat. A vírus aktiválódása kritikus pillanat a sejttel való kölcsönhatásában.
Attól a pillanattól kezdve, hogy a vírus behatol a sejtbe, megkezdődik a HIV-fertőzés időszaka - a vírushordozó állapot, amely 10 évig vagy tovább is eltarthat; és attól a pillanattól kezdve, hogy a vírus aktiválódik, elkezdődik a betegség - az AIDS. Szabályozó génjei és termékeik segítségével a vírus aktívan szaporodni kezd. A TAT fehérje akár 1000-szeresére is növelheti a vírus szaporodásának sebességét. A vírus transzkripciója összetett. Magában foglalja mind a teljes hosszúságú, mind a szubgenomikus mRNS képződését, az mRNS splicingot, majd a strukturális és szabályozó fehérjék szintézisét.
A strukturális fehérjék szintézise a következőképpen történik. Először a Pr55Gag prekurzor poliprotein (egy 55 kDa molekulatömegű fehérje) szintetizálódik. 4 fő domént tartalmaz: mátrix (MA), kapszid (CA), nukleokapszid (NC) és az rb domén, amelyekből a Pr55Gag vírusproteáz általi hasításának eredményeként (ez egy másik prekurzor fehérjéből, a Gag-Pol-ból hasad magától) a p17, p24, p7 és rb strukturális fehérjék képződnek. A Pr55Gag poliprotein kialakulása a vírusrészecskék kialakulásának fő feltétele. Ez a fehérje határozza meg a virion morfogenezis programját. Ez egymás után magában foglalja a Gag poliprotein plazmamembránba történő transzportjának, a vele való kölcsönhatásnak, valamint a fehérje-fehérje kölcsönhatásoknak a vírusrészecske kialakulása és sarjadása során történő szakaszait. A Pr55Gag szabad poliriboszómákon szintetizálódik; a fehérjemolekulák a membránra szállítódnak, ahol hidrofób régióikkal rögzítik őket. A CA domén játssza a fő szerepet a Gag fehérje natív konformációjának kialakításában. Az NC domén biztosítja ("cink ujjai" segítségével) két genomiális RNS molekula beépülését a képződő vírusrészecske összetételébe. A poliprotein molekula kezdetben a mátrixdomének kölcsönhatása miatt dimerizálódik. Ezután a dimerek a CA és NC domének kölcsönhatása eredményeként hexamer (6 egységből álló) komplexekké egyesülnek. Végül a hexamerek az oldalsó felületükön egyesülve éretlen gömb alakú virionokat alkotnak, amelyek belsejében a genomiális vírus RNS található, amelyet az NC domén fog be.
Egy másik prekurzor fehérje, a Prl60Gag-Pol (egy 160 kDa molekulatömegű fehérje), a riboszóma által a gag gén 3'-végének transzlációja során bekövetkező kereteltolódás eredményeként szintetizálódik, az rb fehérjét kódoló régiótól közvetlenül felfelé elhelyezkedő régióban. Ez a Gag-Pol poliprotein egy hiányos Gag fehérjeszekvenciát (1-423 aminosav) és olyan Pol szekvenciákat tartalmaz, amelyek magukban foglalják a PR, RT és IN doméneket. A Gag-Pol poliprotein molekulák szintén szabad poliriboszómákon szintetizálódnak, és a plazmamembránba szállítódnak. A Prl60Gagpol poliprotein tartalmazza a Gag poliproteinben rejlő összes intermolekuláris kölcsönhatási helyet és membránkötőhelyet. Ezért a Gag-Pol poliprotein molekulák a membránnal olvadnak össze, és a Gag molekulákkal együtt bekerülnek a képződő virionokba, ami aktív proteáz megjelenéséhez és a virion érési folyamatának megkezdéséhez vezet. A HIV-1 proteáz csak dimer formájában erősen aktív, ezért a Prl60Gag-Pol-ból való önkiválásához ezen molekulák dimerizációja szükséges. A virion érése abból áll, hogy a felszabaduló aktív proteáz a prl60Gag-Pol és Gag55 által felismert helyeken elvágja a fehérjéket; létrejönnek a p17, p24, p7, p6 fehérjék, a revertáz és az integráz, és ezek beépülnek a vírus szerkezetébe.
Az Env fehérje az endoplazmatikus retikulum membránjaihoz kapcsolódó riboszómákon szintetizálódik, majd glikozilálódik, egy sejtes proteáz gp120-ná és gp41-gé hasítja, és a sejtfelszínre szállítódik. Ebben az esetben a gp41 behatol a membránba, és a membrán belső felszínéhez kapcsolódó Gag fehérjemolekula mátrixdoménjeihez kötődik. Ez a kapcsolat az érett virionban is megmarad.
A vírusrészecskék összeszerelődése tehát a prekurzor fehérjék és a hozzájuk kapcsolódó RNS-molekulák aggregációjából áll a gazdasejt plazmamembránján, éretlen virionok képződéséből és azok felszabadulásából a sejtfelszínről rügyezéssel. A rügyezés során a virion egy sejtmembránnal veszi körül magát, amelybe a gp41 és gp120 molekulák beágyazódnak. A rügyezés során vagy esetleg a virionok felszabadulása után megtörténik az érésük, amelyet egy vírusproteáz segítségével hajtanak végre, és amely a Pr55Gag és Prl60Gag-Pol prekurzor fehérjék proteolitikus hasításából áll az érett vírus fehérjéivé, és ezek bizonyos szerkezeti komplexekbe való asszociációjából. A vírus morfogenezisének folyamataiban a vezető szerepet a Pr55Gag prekurzor poliprotein játssza, amely szervezi és összeszereli az éretlen viriont; érési folyamatát egy specifikus vírusproteáz fejezi be.
Az immunhiány okai
A HIV-fertőzés immunhiányának egyik fő oka a T-helperek tömeges pusztulása. Ez a következő események eredményeként következik be. Először is, a vírussal fertőzött T-helperek apoptózis következtében elpusztulnak. Úgy vélik, hogy AIDS-betegeknél a vírusreplikáció, az apoptózis és a T-helperek számának csökkenése összefügg. Másodszor, a T-killer sejtek felismerik és elpusztítják a vírussal fertőzött vagy adszorbeált gpl20 molekulákat hordozó T-sejteket, valamint a vírussal fertőzött és nem vírussal fertőzött T-helpereket, amelyek több tucat sejtből álló szimplasztokat (szinkítiumot) alkotnak (egyesek a bennük lévő vírusok szaporodása következtében elpusztulnak). A nagyszámú T-helper pusztulása következtében csökken a B-limfocitákban az interleukin-2 membránreceptorainak expressziója, a különböző interleukinok (a B-limfociták növekedési faktorai és differenciálódási tényezői - IL-4, IL-5, IL-6 stb.) szintézise zavart szenved, ami a T-killer rendszer működésének zavarához vezet. A komplement és a makrofág rendszerek aktivitása gátolt. A vírussal fertőzött makrofágok és monociták sokáig nem pusztulnak el, de nem képesek eltávolítani a vírust a szervezetből. Végül, a gpl20 szerkezeti és antigén hasonlósága miatt a szervezet egyes hámsejtjeinek receptoraival (beleértve a HIV transzplantációs átvitelét közvetítő trofoblaszt receptorokat is), széles spektrumú antireceptor antitestek szintetizálódnak. Az ilyen antitestek képesek blokkolni a különböző sejtreceptorokat, és bonyolítják a betegség lefolyását autoimmun rendellenességekkel. A HIV-fertőzés következménye az immunrendszer összes fő láncszemének veresége. Az ilyen betegek védtelenné válnak a mikroorganizmusok széles skálájával szemben. Ez opportunista fertőzések és daganatok kialakulásához vezet. A HIV-fertőzött betegeknél legalább háromféle rák kialakulásának kockázata megnő: Kaposi-szarkóma; karcinóma (beleértve a bőrrákot is); B-sejtes limfóma, amely a B-limfociták rosszindulatú átalakulása miatt alakul ki. A HIV azonban nemcsak limfocitotrop, hanem neurotrop is. A központi idegrendszer sejtjeibe (asztrocitákba) receptor-közvetített endocitózissal és vírussal fertőzött limfoblasztok asztrociták általi fagocitózisával jut be. Amikor a vírus kölcsönhatásba lép az asztrocitákkal, szimplasztok is képződnek, amelyek elősegítik a kórokozó terjedését az intercelluláris csatornákon keresztül. A vírus hosszú ideig fennmaradhat a makrofágokban és a monocitákban, így azok rezervoárként és elosztóként szolgálnak a szervezetben, képesek behatolni az összes szövetbe. A fertőzött makrofágok jelentős szerepet játszanak a HIV központi idegrendszerbe történő bejutásában és annak károsodásában. A betegek 10%-ánál az elsődleges klinikai szindrómák a központi idegrendszer károsodásával járnak, és demenciaként jelentkeznek. Így a HIV-fertőzött embereket 3 betegségcsoport jellemzi - opportunista fertőzések,daganatos betegségek és a központi idegrendszer károsodása.
A HIV-fertőzés epidemiológiája
A HIV-fertőzés forrása kizárólag egy személy lehet - beteg vagy vírushordozó. Az emberi immunhiány vírusa (HIV) a vérben, spermiumban, méhnyakváladékban található; szoptató anyáknál - az anyatejben. A fertőzés szexuális úton, vérrel és vérkészítményekkel, valamint anyáról gyermekre terjed a szülés előtt, alatt és után. Étel, ital és rovarcsípés útján történő vírusfertőzés esetei nem ismertek.
A kábítószer-függőség hozzájárul az AIDS terjedéséhez. A HIV előfordulása évről évre növekszik. A WHO szerint 1980 és 2000 között 58 millió ember fertőződött meg HIV-vel. Csak 2000-ben világszerte 5,3 millió ember fertőződött meg, és 3 millió ember halt meg AIDS-ben. 2004. január 1-jén 264 ezer HIV-fertőzöttet regisztráltak Oroszországban. A HIV-fertőzöttek fele a fertőzéstől számított 11-12 éven belül meghal. 2004 elején Oroszország minden 100 ezer állampolgárából körülbelül 180 élt "HIV-fertőzés" diagnózisával. Az előrejelzések szerint ezzel a morbiditási szinttel Oroszországban a HIV-fertőzöttek teljes száma 2012-re 2,5-3 millió ember lesz. A HIV-fertőzés elleni küzdelem összetettsége számos okból függ: először is, nincsenek hatékony módszerek a kezelésére és a specifikus megelőzésre; másodszor, a HIV-fertőzés lappangási ideje meghaladhatja a 10 évet. Időtartama a T-limfocita aktiválódásának pillanatától és a kromoszómájában található DNS provírustól függ. Még mindig nem világos, hogy minden vírussal fertőzött személy AIDS-re van-e ítélve, vagy lehetséges-e a vírus hosszú távú, betegség nélküli hordozása (ami valószínűtlennek tűnik). Végül számos humán immunhiányos vírus (HIV-1, HIV-2) létezik, amelyek antigénbeli különbségei megakadályozzák a keresztimmunitás kialakulását. A majom immunhiányos vírus (SIV) felfedezése fényt derített a HIV eredetének kérdésére. A SIV genomszerveződésében hasonló a HIV-hez, de nukleotidszekvenciájában jelentősen eltér. A HIV-2 szerológiai tulajdonságaiban a HIV-1 és a SIV között köztes helyet foglal el, nukleotidszekvenciájában pedig közelebb áll a SIV-hez. E tekintetben V. M. Zsdanov azt feltételezte, hogy a HIV-1, HIV-2 és SIV vírusok egy közös őstől származnak. R. Gallo szerint lehetséges, hogy az egyik SIV valahogy bejutott az emberi szervezetbe, ahol mutációk sorozatán ment keresztül, ami a HIV-1, a HIV-2 és más formáinak megjelenéséhez vezetett.
A HIV-fertőzés tünetei
Az emberi immunhiányos vírusnak (HIV) vannak olyan jellemzői, amelyek nagymértékben meghatározzák a betegség patogenezisét. A vírus nagyon magas szaporodási sebességgel rendelkezik, amelyet szabályozó elemei határoznak meg (aktív stádiumban akár 5000 virion is szintetizálódik 5 perc alatt). A fúziós fehérje (gp41) jelenléte miatt a vírus a fertőzött és nem fertőzött T-helperek fúziója miatt kiterjedt szincíciális struktúrák kialakulását idézi elő, ami tömeges pusztulásához vezet. A nagy mennyiségben képződő gpl20 fehérjemolekulák szabadon keringenek a vérben, és a nem fertőzött T-helperek receptoraihoz kötődnek, aminek következtében a T-killerek is felismerik és elpusztítják őket. A vírus intercelluláris csatornákon keresztül terjedhet sejtről sejtre, ilyenkor az antitestek számára nehezen hozzáférhetővé válik.
A HIV-fertőzés klinikai kritériumai
Felnőtteknél a HIV-fertőzést akkor diagnosztizálják, ha legalább két súlyos tünet jelentkezik legalább egy enyhe tünettel kombinálva, és az immunhiány egyéb ismert okai (rák, veleszületett immunhiány, súlyos éhezés stb.) hiányában. A súlyos tünetek a következők:
- 10%-os vagy annál nagyobb súlycsökkenés;
- hosszan tartó lázas állapot, időszakos vagy állandó;
- krónikus hasmenés.
Enyhébb tünetek: tartós köhögés, generalizált dermatitis, visszatérő herpes zoster, szájüregi és garatgyulladás, krónikus herpes simplex, generalizált nyirokcsomó-gyulladás. Az AIDS diagnózisát csak Kaposi-szarkóma, cryptococcus okozta agyhártyagyulladás, pneumocystis pneumonia jelenlétében állítják fel. A betegség klinikai képét befolyásolja a kísérő opportunista fertőzés.
A humán immunhiányos vírus (HIV) tenyésztésének módszerei
A HIV-1 és a HIV-2 egyetlen TCV4 limfocita klónból - a leukémiás TCV4 limfocitákból származó H9-ből - álló sejtekben tenyészthető. Az asztrocita sejtek egyrétegű tenyészetei, amelyekben a HIV-1 jól szaporodik, szintén használhatók erre a célra. Az állatok közül a csimpánzok fogékonyak a HIV-1-re.
A vírus ellenálló képessége külső környezetben alacsony. Napfény és UV-sugárzás hatására elpusztul, 80 °C-on 30 percen belül, általánosan használt fertőtlenítőszerekkel kezelve pedig 20-30 percen belül elbomlik. A vírust tartalmazó anyagok fertőtlenítéséhez mikobaktericid fertőtlenítőszereket kell használni, mivel ezek hatékonyak a legnagyobb ellenálló képességű mikroorganizmusok ellen.
A HIV-fertőzés laboratóriumi diagnosztikája
A vírushordozóság és a HIV-fertőzés diagnosztizálásának fő módszere az enzimes immunvizsgálat. Azonban, mivel a gpl20 szerkezeti és antigén hasonlóságot mutat egyes emberi sejtek receptoraival, beleértve azokat a receptorokat is, amelyek immunglobulinokat szállítanak a nyálkahártyák hámsejtjein keresztül, a gpl20 elleni antitestekkel rokon antitestek jelenhetnek meg a szervezetben. Ebben az esetben álpozitív ELISA eredmények is előfordulhatnak. Ezért az alanyok összes pozitívan reagáló szérumát további elemzésnek vetik alá immunoblot módszerrel, vagy Western blot módszerrel. Ez a módszer a vizsgált antitestek azonosításán alapul elektroforetikus elválasztása és az azt követő jelölt fajellenes antitestekkel történő tesztelés után. A virológiai módszert ritkán alkalmazzák a vírus tenyésztésének összetettsége miatt. A H9 limfocitaklónt használják vírusantigének - a diagnosztikai tesztrendszerek szükséges összetevőinek - kinyerésére. A CPR módszer lehetővé teszi a vírus kimutatását a virémia korai szakaszában.
HIV-fertőzés kezelése
Szükséges olyan gyógyszereket találni vagy szintetizálni, amelyek hatékonyan gátolják a reverz transzkriptáz (revertáz) vagy a vírusproteáz aktivitását. Ezek megakadályoznák a DNS-provírus képződését és (vagy) gátolnák a vírus intracelluláris szaporodását. A HIV-fertőzött betegek kezelésének modern stratégiája a vírusproteázt (az egyik gyógyszer) és a reverzázt (2 különböző gyógyszer) gátló gyógyszerek kombinált alkalmazásának elvén alapul - kombinált (hármas) terápia. Oroszországban a HIV-fertőzött betegek kezelésére két hazai gyógyszer kombinált alkalmazását ajánlják: a foszfazidot és a krixivánt, amelyek specifikusan gátolják a HIV szaporodását a szaporodás korai és késői szakaszában, különösen az azidotimidin csökkent aktivitása esetén.
A specifikus profilaxis problémája egy olyan vakcina létrehozásának szükségessége, amely biztosítaná a hatékony, sejtközvetített immunitás kialakulását vírusspecifikus citotoxikus limfociták alapján, jelentős antitesttermelés nélkül. Az ilyen immunitást a Thl segítők biztosítják. Lehetséges, hogy az antitestek, beleértve a vírusneutralizálókat is, nemcsak hatástalanok a HIV-fertőzés elnyomásában, hanem magas szinten elnyomják a sejtközvetített immunitást. Ezért egy HIV-ellenes vakcinának mindenekelőtt két fő követelménynek kell megfelelnie: a) teljesen biztonságosnak kell lennie, és b) stimulálnia kell a T-citotoxikus limfociták aktivitását. Vizsgálják az elölt (inaktivált) vírusokból és a magas védő tulajdonságokkal rendelkező egyedi antigénekből nyert különféle vakcinaváltozatok hatékonyságát. Az ilyen antigéneket vagy magukból a virionokból lehet izolálni, vagy kémiailag szintetizálni. Javasoltak egy géntechnológiai módszerekkel létrehozott vakcinát. Ez egy rekombináns vaccinia vírus, amely HIV-géneket hordoz, amelyek felelősek az erős immunogén tulajdonságokkal rendelkező antigének szintéziséért. Ezen vakcinák hatékonyságának kérdése jelentős időt igényel a HIV-fertőzés hosszú inkubációs ideje és a kórokozó nagyfokú variabilitása miatt. A HIV elleni, nagy hatékonyságú vakcina létrehozása sürgető alapvető probléma.

