A cikk orvosi szakértője
Új kiadványok
Gyógyszerek
Trombózist megelőző és a vér reológiáját javító gyógyszerek
Utolsó ellenőrzés: 07.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
A sokk során a többszörös mikrotrombusok kialakulásának és azok pusztulásának megelőzésében különféle farmakológiai megközelítések alkalmazhatók, amelyek olyan gyógyszereket alkalmaznak, amelyek megakadályozzák a trombusképződést és javítják a vér reológiáját:
- szisztémás hemodinamikai és mikrocirkulációs zavarok kiküszöbölése vazoaktív és inotrop szerek alkalmazásával;
- a vér reológiájának javítására irányuló intézkedések racionális infúziós terápia és az eritrocita membránok rugalmasságát helyreállító gyógyszerek (trental vagy pentoxifillin) alkalmazásával;
- a vérlemezke-aggregáció megelőzése és a kezdeti „fehér” trombusok képződése a kis artériás erekben, majd a koagulációs kaszkád megindítása;
- a trombusképződés gátlása a szisztémás koagulációs kaszkád aktiválása után;
- a fibrinolízis aktiválása az újonnan képződött vérrögök feloldása céljából (fibrinolizin, sztreptokináz, sztreptodekáz, urokináz stb.), vagy éppen ellenkezőleg, a fibrinolízis gátlása, amikor traumás sokkban és szepszisben szenvedő betegeknél generalizálódik (aminokapronsav, amben, kontrakál stb.).
A felsorolt megközelítések többsége hagyományos, jól fejlett a sokk kezelésének gyakorlatában, saját hemoreológiai indikációkkal rendelkeznek, és a vonatkozó fejezetekben szerepelnek. Ezért ebben a szakaszban célszerű a vérrögképződés megelőzésének általános megközelítésére összpontosítani sokkban, olyan farmakológiai szerek alkalmazásával, amelyek befolyásolják a véralvadás profázisát. A véralvadási szövődmények megelőzésének ezen szintje - a "fehér artériás trombusok" előfordulása, képződése és növekedése - vonzza a kutatók legnagyobb figyelmét.
A különböző típusú sokkokra jellemzőek a véralvadás különféle és gyakran többirányú zavarai, amelyek a reológiájának romlásával járnak. A szeptikus, endotoxin, égési, traumás és vérzéses sokkok legjellemzőbb típusa a többszörös mikrotrombusok képződése a legkisebb erekben, amelyet a szisztémás hemodinamika zavarai, az érgörcs és a mikrokeringés zavarai, a vér besűrűsödése, az iszapképződés, az eritrocita membránok csökkent rugalmassága, valamint számos általános és helyi tényező (autokoidok) okoz, amelyek lokális változásokat indítanak el a koagulációs hemosztázisban és a véralvadás profázisának bekapcsolódásában.
Vázlatos (rövidített) formában a hemokoaguláció kezdeti szakaszát és a lokális hemokoagulációs homeosztázis mechanizmusát a következőképpen mutatjuk be.
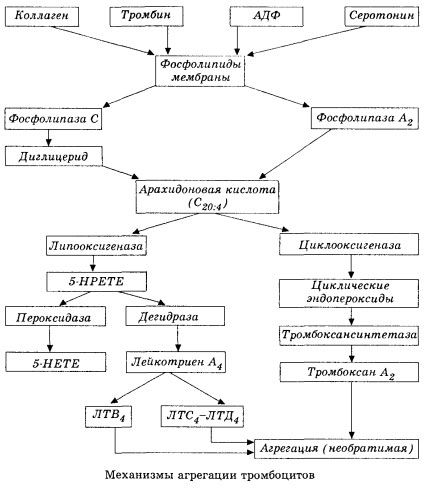
A folyamat a membránfoszfolipáz A2 aktiválódásával kezdődik, melyet károsító tényezők (közvetlen membránkárosodás, hipoxia, lipidperoxidáció, endogén kémiai tényezők hatása stb.) kombinációjának hatására érnek el. A membránfoszfolipidek lebomlása következtében nem észterezett hosszú szénláncú zsírsavak szabadulnak fel, amelyek közül az arachidonsav a legfontosabb kiindulási szubsztrátként. Átalakulása (arachidonsav-kaszkád) a lipoxigenáz (leukotriének szintézise) és a ciklooxigenáz (prosztaglandinok, tromboxánok, prosztaciklin szintézise) útvonalakon keresztül történik.
A keletkező leukotriének (B4, C4, E4, D4 stb.) - rendkívül magas biológiai aktivitású anyagok, amelyek közé tartozik az anafilaxia lassan reagáló anyaga - nagy jelentőséggel bírnak a lokális érrendszeri, gyulladásos és immunreakciók, köztük az autoimmun folyamatok beindításában. A leukotriének mikrokeringési zavarokat, fokozott véralvadást, autolitikus lizoszomális enzimek felszabadulását és egy olyan faktor felszabadulását okozzák a vérben, amely gátolja a szívizom-összehúzódást és a hörgőgörcset.
A simaizom-összehúzódás kiváltására való képességük miatt a leukotriének jelentősen befolyásolják a szisztémás hemodinamikát, a koszorúereket és a szívizomot, erős koszorúér-szűkítőt és negatív inotrop hatást fejtenek ki, amelyet a perctérfogat csökkenése kísér, és fontos szerepet játszik a hipotenzió kialakulásában.
A leukotriénekre adott csökkent perctérfogat és hipotenzív válasz a szívizom gyengülésével és a szívbe történő vénás visszaáramlás korlátozásával jár. A vénás visszaáramlás korlátozásában jelentős jelentőséggel bír a leukotriének azon képessége, hogy növelik az érfal permeabilitását és plazma-extravazációt okoznak. A leukotriéneket fontosnak tartják a miokardiális infarktus patogenezisében.
Anafilaxiás és szeptikus (endotoxin) sokk esetén szerepük látszólag még jobban megnő, amint azt a leukotriének azon képessége is bizonyítja, hogy allergiás reakciók során jelentős mennyiségben felhalmozódnak a plazmában, és az anafilaxiás sokkra jellemző szisztémás véráramlási változásokat idéznek elő, valamint a leukotrién receptor blokkolók és a lipoxigenáz inhibitorok védőhatása is bizonyítja. A szelektív leukotrién receptor blokkolók fejlesztése meglehetősen intenzíven folyik, és ígéretes tudományirány. Ezen a területen már sikerült némi sikert elérni, és az ilyen blokkolók hatékonyságát miokardiális ischaemiában, endotoxinban és vérzéses sokkban kísérletileg is igazolták. Valószínűleg azonban még több évbe telik, mire ez az irány klinikailag is megvalósul.
Ha a vénás erekben a trombusok a trombociták és a plazma koagulációs faktorok egyenlő arányú részvételével képződnek, akkor az artériákban a trombociták a folyamat fő iniciátorai. Tartalmaznak ADP-t, Ca2+-t, szerotonint, foszfolipideket, prosztaglandin és tromboxán szintézis enzimeket, trombosztenint (az izom-aktomiozinhoz hasonlóan biztosítja ezen sejtek összehúzódási képességét), az érfal hám- és izomsejtjeinek trombogén növekedési faktorát és számos más anyagot. A trombocitafunkciók humorális szabályozása membránjaik specializált receptorain keresztül történik (alfa2- és béta2-adrenoreceptorok, hisztamin- és szerotonin receptorok, acetilkolin, tromboxán, adenozin és számos más). A trombociták különleges tulajdonsága a kollagén és az érfal más szubendoteliális elemei, valamint a nem nedvesítő és negatív töltésű felületek iránti nagy affinitás. Ez a tulajdonság kivételes képességet biztosít a trombocitáknak arra, hogy a sérült endotéliummal rendelkező érszakaszhoz tapadjanak, amelynek nagy a valószínűsége a sérülésre sokk esetén. Ebben az esetben a trombociták szétterjednek és álpódiumokat szabadítanak fel, amelyek egymáshoz és az érfalhoz tapadhatnak. A membrán permeabilitása megnő, és a trombocita felszínén adszorbeált ADP, szerotonin, tromboxán és néhány véralvadási faktor szabadul fel a trombocitákból. Ezek az anyagok kölcsönhatásba lépnek a membránon található megfelelő receptorokkal, és kalciumionok részvételével aggregációt okoznak (kezdetben reverzibilisen). A folyamat önfenntartóvá válik, amit a humorális szabályozó faktorok is elősegítenek; más tényezők ezzel szemben megállíthatják, sőt vissza is fordíthatják, dezaggregációt okozva.
A trombusképző hatások és körülmények túlsúlyával az adhéziós és reverzibilis aggregációs fázisokat a harmadik fázis - az irreverzibilis aggregáció - váltja fel, amelyet trombosztenin részvételével hajtanak végre, és a vérrög összehúzódásához vezet; az aggregáns erősödésének és az összehúzódásnak a reakciója szintén Ca+, ATP részvételével történik, és fehér trombus kialakulásához vezet.
Az arachidonsav vérlemezkékben, érrendszeri endotélsejtekben és más szövetekben történő átalakulásának ciklooxigenáz útvonala biztosítja a lokális (a metabolitok felezési ideje nagyon rövid) koagulációs homeosztázist, mivel ezen anyagcsere során erős pro- és antiaggregáns anyagok képződnek. A ciklooxigenáz reakcióláncban a vérlemezke-aggregációt aktiváló fő tényező a tromboxán A2, és nem kevésbé erős antagonistája a prosztaciklin, amelyet az endotélsejtek termelnek, és kisebb mértékben az E és G sorozatú prosztaglandinok. Végül a vérlemezke-aggregációt erősen befolyásolják további lokális és szisztémás humorális faktorok.
Vérlemezke-aggregáció aktivátorok és inhibitorok
A vérlemezke-aggregáció iniciátorai és aktivátorai |
Vérlemezke-aggregáció-gátlók |
Kollagén |
- |
ADP |
Adenozin és stabilizátorai |
Noradrenalin (alfa2 receptorokon keresztül) |
Alfa-adrenerg blokkolók |
Szerotonin |
Antiszerotonin szerek |
Hisztamin |
Antihisztaminok |
Trombin |
Heparin |
Ca2+ |
Ca2+ antagonisták |
CGMP - induktorai (acetilkolin?) és stabilizátorai |
CAM - induktorai (béta-adrenerg receptorokon keresztül) és stabilizátorai (foszfodiészteráz inhibitorok) |
Arachidonsav |
Dextránok, albumin |
Tromboxán A2 |
Prosztaciklin I2 |
A szívben és az agyban fellépő sokk és akut ischaemiás folyamatok esetén a trombusképződés kezdeti fázisában alkalmazott farmakológiai beavatkozások a következő lehetőségekre utalnak:
- az arachidonsav-kaszkád kezdeti reakcióinak (teljes és részleges) gátlása;
- a tromboxán szintézisének egy adott reakciójának gátlása;
- a leukotriének és tromboxánok receptorainak blokkolása a vérlemezkékben, a simaizmokban és más sejtekben;
- olyan anyagok alkalmazása, amelyek modulálják a vérlemezke-aggregációt, azaz más módon gyengítik az utóbbi reakcióját az iniciáló faktorok (kollagén, tromboxán A2, leukotriének stb.) hatására.
A vér reológiai tulajdonságainak rendellenességeinek korrekciójára felsorolt módszerek megvalósítása a fő taktikai feladat megoldását biztosítja: a vérlemezkék aggregációs és adhéziós receptorainak védelme az aktivátorok hatásától, vagy ezen receptorok intracelluláris szintézismechanizmusainak elnyomása. Az arachidonsav-kaszkád kezdeti reakcióinak gátlása a polimer aktivátorokra reagáló vérlemezke-receptorok kis molekulatömegű dextránok alkalmazásával érhető el, amelyek molekulái versenyeznek a fibrinnel, a kollagénnel, az aggregált immunglobulinnal (IgE) és a komplementrendszer komponenseivel.
A vérlemezke membránján lévő receptorok elfedésével és az eritrociták felszínén lévő nagy diszpergált fehérjékkel való versengéssel a kis molekulatömegű dextránok kiszorítják azokat és lerombolják a sejtek közötti hidakat. Ez annak köszönhető, hogy a dextránok, amelyek beborítják az ér endotéliumát és a vérsejt elemek felszínét, növelik azok negatív töltését, ezáltal fokozva az antiaggregációs tulajdonságokat.
Dextransz
Az alacsony molekulatömegű dextránok csökkentik a kollagén és ADP által kiváltott vérlemezke-aggregációt, valamint a trombin vérlemezkékre gyakorolt aktiváló hatását, gátolják a kezdeti fehérvérsejt-trombus növekedését, javítják a véráramlást, csökkentik a plazma fibrinogén tartalmának posztoperatív növekedését, valamint megváltoztatják a fibrin szerkezetét és stabilitását.
A dextránok intravénás infúziója traumában és sokkban nemcsak a vérlemezke-aggregációt és -adhéziót csökkenti, hanem mobilizálja az endogén heparint is, ezáltal elősegítve a laza és nehezen összehúzódó vérrög kialakulását, amelyet a fibrinolitikumok könnyen lizálnak. Az alacsony molekulatömegű dextránok antitrombin aktivitása összefügg a VIII-as véralvadási faktor szerkezetére és működésére gyakorolt specifikus hatásukkal. A VIII-as faktor (antihemofil globulin), egy összetett szerkezetű és funkciójú nagy molekula, részt vesz a vérlemezke-aggregációban és a keletkező vérrög stabilitásában. A dextránok zavarják a VIII-as faktor hatását, ezáltal lassítják a vérlemezke-aggregációt és csökkentik a vérrög stabilitását.
Az alacsony molekulatömegű dextránok nem valódi antikoagulánsok, és korrekciós hatásuk a hemorheológiai rendellenességekben főként a hemodilúcióval, a keringő plazma térfogatának feltöltésével és a mikrokeringési rendszer véráramlásának javulásával jár.
A dextránok hemodinamikai rendellenességekben (sokk, vérveszteség) a véráramlás javítására való képessége számos tényezőnek köszönhető. A polimer magas, átmeneti koncentrációjának előfordulása a vérben nemcsak "közvetlen hemodilúcióhoz" vezet, hanem megteremti a feltételeket a folyadéknak az intersticiális térből a véráramba történő áramlásához, és a dextrán ozmotikus hatásának ezt követő kiegyensúlyozásához is. A hemodilúció következtében csökken a vér viszkozitása, nő a vénás beáramlás a szívbe, és nő a perctérfogat. Ezen hatások mellett a dextránok komplexeket képeznek a fibrinogénnel, és antilipémiás hatásuk van.
Így az alacsony molekulatömegű dextránok aggregációgátló hatása és hemodinamikai hatásai hozzájárulnak a vér viszkozitásának csökkentéséhez, ami különösen fontos alacsony nyírási sebességek esetén. A vérsejtek szétesése javítja a szisztémás véráramlást és a mikrokeringést, különösen annak vénás részében, ahol a sebességgradiensek a legalacsonyabbak. Az alacsony molekulatömegű dextránoldatok alkalmazása különböző típusú sokkok esetén, sérülések és azok következményeinek sebészeti kezelése során, majd a posztoperatív időszakban segít megelőzni a hiperkoagulációt és csökkenti a trombotikus folyamatok és az embólia valószínűségét.
Meg kell azonban jegyezni, hogy bizonyos esetekben a dextránoldatok infúzióját anafilaxiás és allergiás reakciók kísérik (veszélyes szenzibilizáció és anafilaxiás sokk esetén). Ez annak köszönhető, hogy a nagy molekulatömegű és sok oldalláncú dextránok antigénként működhetnek. Ezért az egyéni érzékenység megállapítása érdekében ajánlott intravénásan legfeljebb 20 ml kis molekulatömegű dextránoldatot beadni haptén formájában (15%-os oldat, molekulatömeg 1000), és az érzéstelenítés bevezetése előtt plazmapótló infúziót végezni.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Trombin inhibitorok
A vérlemezke-aktivátorokkal kölcsönhatásba lépő vérlemezke-receptorok farmakológiai védelme olyan szerekkel is elérhető, amelyek versengenek a nem polimer vérlemezke-aktivátorokkal, vagy gátolják azokat. Ilyen szerek például a trombin inhibitorok (heparin és hirudin, számos szintetikus inhibitor, adrenalin antagonisták), az alfa-receptor blokkolók (fentolamin, dihidroergotamin), az ADP antagonisták (dipiridamol, adenozin és szerkezeti analógjai, foszfokreatin), a szerotonin antagonisták (metizergid). A felsorolt szerek közül csak néhányat alkalmaznak ténylegesen különböző eredetű sokk megelőzésére és kezelésére.
A vérlemezke-aggregáció és -adhézió aktivátoraival reagáló fehérjereceptorok intracelluláris szintézismechanizmusainak védelme, valamint a tromboxán szintézis folyamatainak gátlása különböző csoportokba tartozó gyógyszerekkel lehetséges:
- cATP, prosztaciklin és prosztaglandin PgE2 induktorai és stabilizátorai;
- foszfolipáz és foszfodiészteráz inhibitorok.
A speciális vérlemezkegátló szerek intenzív fejlesztése viszonylag nemrég kezdődött, és még nem vezetett megbízható eredményekhez. Jelenleg a klinikai gyakorlatban a dextrán oldatok mellett széles körben alkalmazzák a fehérvérsejt-trombusok kialakulásának megelőzésére olyan vérlemezkegátló szereket, mint az acetilszalicilsav, az indometacin, a dipiradamol, a szulfinpirazon (persantin), a prosztaciklin (eikoprosztenon) és a heparin.
Nem szteroid gyulladáscsökkentő gyógyszerek
Megállapították, hogy a nem szteroid gyulladáscsökkentő gyógyszerek - az acetilszalicilsav és az indometacin - farmakológiai hatásai az eikozanoidok (tromboxánok és prosztaglandinok) anyagcseréjére gyakorolt hatásuknak köszönhetők. Az ebbe a csoportba tartozó gyógyszerek szinte mindegyike gátolja a prosztaglandin-szintetáz néven ismert enzimkomplexet, ezáltal specifikus és antiaggregáns hatásukat fejti ki.
Az acetilszalicilsav orális adagolás után nagyon gyorsan felszívódik. Hidrolízisének terméke, a szalicilsav, gátolja a vérlemezke ciklooxigenáz enzimjét, ami megzavarja az arachidonsav prosztaglandin O2-vé, és végső soron tromboxán A2-vé történő átalakulását. Az acetilszalicilsav gátolja a kollagén, az ADP, az adrenalin és a szerotonin által kiváltott aggregációt. Bár a GG0 5 értéke 15 perc, az antiaggregáns hatás több napig tart, ami nyilvánvalóan a prosztaglandin szintézis reakciók irreverzibilis gátlásával és a vérlemezke-aggregációs funkció elnyomásával magyarázható teljes életük során (6-10 nap). A vérlemezke ciklooxigenáz gátlása mellett az acetilszalicilsav nagy dózisban gátolja az érfal ciklooxigenáz enzimjét, és a tromboxán A2 szintézis elnyomásával egyidejűleg gátolja a prosztaciklin szintézist az endothelsejtekben. Ezért az acetilszalicilsavat antiaggregánsként kis dózisokban (3000-5000 mg/nap) kell felírni, amelyek túlnyomórészt gátolják a vérlemezke-aggregációt.
Figyelembe véve, hogy az acetilszalicilsav több napig blokkolja a vérlemezke ciklooxigenázt, az endoteliális ciklooxigenázt pedig legfeljebb egy napig, célszerű a gyógyszert nem naponta, hanem 3-4 naponta felírni. Az acetilszalicilsav optimális dózisának kiválasztását a beteg számára egyénileg kell elvégezni, mivel a betegek érzékenysége a gyógyszer vérlemezke-gátló hatására eltérő. Reaktív betegeknél az acetilszalicilsav 0,5 g-os dózisban 40-50%-kal, hiperreaktív betegeknél teljesen vagy 80-90%-kal gátolja a vérlemezke-aggregációt, míg reaktív betegeknél a vérlemezke-gátló hatás hiánya jellemző a gyógyszer azonos dózisának bevétele esetén.
A szelektív tromboxán-szintetáz inhibitorok az imidazol és analógjai, amelyek nem blokkolják a ciklooxigenázt. A dipiridamol, amelyet a klinikai gyakorlatban krónikus ischaemiás szívbetegség kezelésében koszorúér-tágítóként alkalmaznak, az imidazolhoz hasonlóan szelektíven gátolja a tromboxán-szintetázt, megakadályozva a tromboxán A2 szintézisét. Úgy vélik, hogy a gyógyszer és analógjai a vérlemezke-foszfodiészterázt is gátolják, ezáltal növelve a cAMP koncentrációját a vérlemezkékben. Ezzel együtt a dipiridamol gátolja az adenozin-deamináz aktivitását és az adenozin felvételét a vérlemezkék által, blokkolja a szerotonin felszívódását a vérlemezkék által és az adrenalin és a kollagén által indukált aggregációjukat. Jelentések vannak a gyógyszer gyenge vérlemezke-gátló aktivitásáról és arról, hogy kis dózisokban képes fokozni a vérlemezke-aggregációt. A legmegbízhatóbb vérlemezke-gátló hatás a dipiridamol és az acetilszalicilsav kombinációjával érhető el.
Heparin
Az antitrombotikus szerek közül a vér aggregátumállapotának egyik leghatékonyabb szabályozója a heparin, különösen korai alkalmazás esetén. A heparin nagy negatív töltésű, és képes kölcsönhatásba lépni mind nagy, mind kis ionokkal és molekulákkal (enzimek, hormonok, biogén aminok, plazmafehérjék stb.), így biológiai hatásának spektruma meglehetősen széles. A gyógyszer antitrombin, antitromboplasztin és antiprotrombin hatással rendelkezik, megakadályozza a fibrinogén fibrinné alakulását, gátolja az alvadék visszahúzódását és fokozza a fibrinolízist.
A heparin antikoaguláns hatásának mechanizmusa meglehetősen összetett. Megállapították, hogy a heparin antikoaguláns hatásai az antitrombin III hatásának fokozásával és a heparin-antitrombin III komplex azon képességének fokozásával járnak, hogy gyorsan inaktiválja a véralvadási rendszer legtöbb szerin proteázát. A heparin antitrombotikus hatásában nagy jelentőséggel bír az a képessége, hogy növeli és fenntartja az ér intima magas elektronegatív potenciálját, megakadályozva a vérlemezkék adhézióját és a vérlemezke-mikrotrombusok képződését. A heparin a legaktívabban gátolja a trombusképződést a vénákban, megakadályozva mind a lokális trombusképződést, mind a disszeminált intravaszkuláris koagulációt.
Prosztaciklin és stabil analógjai
A vérlemezke-gátló szerek közül a legerősebb aggregációgátlók a prosztaciklin és stabil analógjai. A prosztaciklin vérlemezke-gátló hatása az adenilát-cikláz stimulációjának és ennek következtében a vérlemezkékben a cAMP koncentrációjának növekedésének, a tromboxán-tartalom csökkenésének, a tromboxán A2-tartalom csökkenésének és receptorainak blokkolásának köszönhető. A prosztaciklin instabil és gyorsan inaktív termékekké hidrolizálódik, ezért intravénásan cseppentve adják be 2-20 ng/kg/perc sebességgel 30-60 percig, naponta legfeljebb 6 alkalommal.
A prosztaciklin az erős antiaggregációs hatás mellett erőteljes értágító és hörgőtágító hatással is rendelkezik. A gyógyszer tágítja az agy, a szív, a vesék, a vázizmok és a bélfodri erek ereit. A prosztaciklin hatására fokozódik a koszorúér-véráramlás, megnő a szívizom energiaellátása és csökken az oxigénigénye. A szervezetben betöltött instabilitása ellenére a klinikailag kedvező hatások több hétig, sőt hónapig is eltarthatnak. Az ilyen elhúzódó hatás mechanizmusa még nem tisztázott.
A prosztaciklin alacsony toxicitású gyógyszer, de alkalmazása mellékhatásokat okozhat: arcpír, fejfájás, vérnyomáscsökkenés, hasi fájdalom, étvágytalanság. A prosztaciklin mellett szintetikus stabil analógjai (iloproszt stb.) ígéretes vérlemezke-aggregáció-gátlók.
A vér viszkozitását javító gyógyszerek
A vér reológiai tulajdonságainak zavarait trauma és sokk esetén nemcsak a vérlemezkék funkcionális aktivitásának változásai okozzák, hanem a vér viszkozitásának növekedése is. A vér szerkezeti viszkozitását, mint komplex, dinamikus, diszpergált rendszert, nagymértékben a plazma viszkozitása és az eritrociták deformációs képessége határozza meg. A plazma viszkozitása főként a vérben lévő fehérjék koncentrációjától függ. A kis molekulatömegű fehérjék, mint például az albumin, csekély hatással vannak a plazma viszkozitására, míg a nagy molekulájú fehérjék (fibrinogén, alfa- és gamma-globulinok, egyéb makromolekulák) jelentősen növelik azt.
Alacsony nyírási sebességeknél a fibrinogén és a globulinok adszorpciója az eritrociták felszínén hidak kialakulásához vezet a szomszédos sejtek között, és az eritrocitákból aggregátumok képződéséhez. Az aggregátumok képződésének sebessége összetett biofizikai folyamat, és nemcsak a nyírás nagyságától, hanem az eritrociták elektrokinetikai tulajdonságaitól, az aggregátor makromolekulák koncentrációjától, tömegétől és szorpciós kapacitásától, az eritrociták alakjától és plaszticitásától is függ.
Az eritrocita membrán alakjának és mechanikai tulajdonságainak fenntartása jelentős energiafelhasználást igényel. Úgy vélik, hogy az eritrocitákban a glikolízis során termelődő energia a spektrin foszforilációjára fordítódik, ami a fehérje másodlagos szerkezetének megváltozásához és a belső membrán szomszédos komponenseivel való kölcsönhatáshoz vezet. A membrán strukturális fehérjéi, a spektrin és az aktin közötti kölcsönhatás fontos szerepet játszik az eritrocita membrán mechanikai tulajdonságainak kialakulásában, az eritrocita felületének és vastagságának állandó szinten tartásában bármilyen deformáció alatt.
Szisztémás hemodinamikai és szervi véráramlási zavarok esetén az eritrocita membránok merevségének növekedése és az eritrocita aggregátumok képződése az eritrociták kapillárisokon keresztüli áthaladási sebességének csökkenéséhez vezet, ezáltal megzavarva a vér gázszállítási funkcióját. Ezért a sokkos állapotban lévő vér reológiai tulajdonságainak zavarainak korrekciója magában foglalja az eritrocita-aggregáció megelőzésével együtt a plazma és a vér viszkozitásának, az eritrociták aggregációjának és deformációjának normalizálását.
Az alacsony molekulatömegű dextránok mellett az albuminoldatok a vér szuszpenzióstabilitásának növelésére szolgáló egyik hatékony eszköz. A sokk késői szakaszában az eritrociták generalizált aggregációja a vérplazma albuminkoncentrációjának csökkenésével és a fibrinogén és globulinok, különösen az alfa2 frakció, a lipoproteinek és a lipidek koncentrációjának növekedésével párhuzamosan következik be. Ilyen körülmények között az albumin reológiai hatásai két fő tényezőnek köszönhetők: a hemodilúciónak és a plazmában lévő mikro- és makroglobuláris fehérjék arányának normalizálódásának. Ugyanakkor az albumin szabad savakhoz kötődik, amelyek labilizációja trauma és sokk során serkenti a vér sejtszerkezeteinek aggregációját és az intravaszkuláris koagulációt, és zsírembóliát okozhat.
A keringő vér mennyiségének pótlására, a szöveti hipoxia és a metabolikus acidózis kiküszöbölésére irányuló antisokk intézkedések hozzájárulnak az eritrocita membránok rugalmasságának normalizálódásához, mivel a hipoxia és az acidózis jelentősen csökkenti az eritrociták deformálhatóságát. Az eritrocita membránok fokozott merevsége sokkban valószínűleg az eritrocitákban az ATP-szintézis gátlásával jár. Az ATP-koncentráció csökkenése viszont hozzájárul a Ca2+-koncentráció növekedéséhez az eritrocitákban, amely a membránfehérjékhez kötődve növeli a membrán merevségét.
Az eritrociták ATP-tartalmát és az eritrociták membránjainak rugalmasságát növelő farmakológiai gyógyszerek egyike a Trental (pentoxifillin), amelyet a klinikai gyakorlatban ischaemiás rendellenességek kezelésére alkalmaznak.
A vörösvértest membránok merevségének csökkentése mellett a Trental értágulatot okoz, javítja a szövetek oxigénellátását, gátolja a foszfodiészteráz aktivitását a szövetekben, növeli a cAMP koncentrációját és gátolja a vérlemezke-aggregációt.
Az eritrocita membrán rugalmasságát fenntartó egyéb farmakológiai szerek közül érdemes megjegyezni a Ca2+ antagonistákat, amelyek korlátozzák az ionok áramlását az eritrocitákba (flunarizin, nifedipin stb.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Figyelem!
Az információk észlelésének egyszerűsítése érdekében a gyógyszer "Trombózist megelőző és a vér reológiáját javító gyógyszerek" gyógyszerre vonatkozó utasítását a gyógyszer orvosi használatára vonatkozó hivatalos utasítások alapján külön formában lefordítják és bemutatják. Használat előtt olvassa el a gyógyszerhez közvetlenül hozzárendelt megjegyzést.
A tájékoztatás tájékoztató jellegű, és nem vezet az öngyógyításhoz. Ennek a gyógyszernek a szükségességét, a kezelés rendjét, módszereit és a gyógyszer adagját kizárólag a kezelőorvos határozza meg. Az öngyógyítás veszélyes az egészségére.

