A cikk orvosi szakértője
Új kiadványok
Veszettség gyermekeknél
Utolsó ellenőrzés: 04.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
A veszettség, vagy hidrofóbia, egy akut vírusos betegség, amely fertőzött állat harapásával terjed, idegrendszeri károsodással és súlyos, halálos kimenetelű agyvelőgyulladás kialakulásával jár.
Járványtan
Az ókor óta közegészségügyi csapásként emlegetett veszettség vírusa jelenleg évente körülbelül 59 000 ember halálát okozza, amelyek szinte mindegyikét kutyaharapás okozza. Ennek jelentős gazdasági hatása van a fejlődő országokra, különösen Afrikára és Ázsiára, amelyek a legkevesebb ilyen veszteséget tudják elviselni. A közel 100%-os halálozási arány ellenére azonban a kutyaveszettség teljes mértékben megelőzhető betegség, és a fejlett világban a kutyaveszettség felszámolásának történelmi példái ezt alátámasztják. [ 1 ]
Okoz veszettség
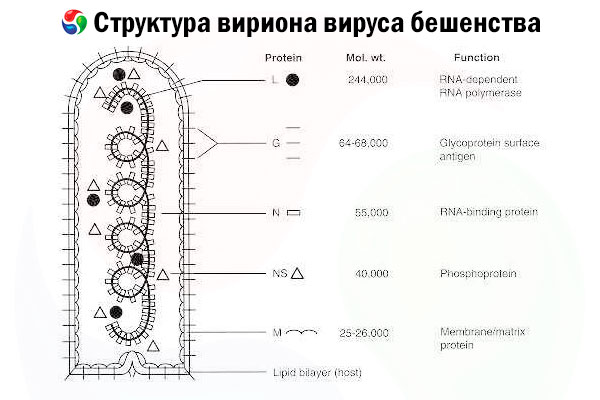
A kórokozó a veszettség vírusa (RV), egy negatív szálú RNS-vírus a rabdovírusok családjából, amelynek mérete körülbelül 60 nm × 180 nm.
Egy belső fehérjemagból, vagy nukleokapszidból áll, amely nukleinsavat tartalmaz, és egy külső membránból, egy lipidtartalmú kettősrétegből, amelyet transzmembrán glikoprotein tüskék borítanak. Viszonylag egyszerű moduláris genomszerkezettel rendelkezik, és öt strukturális fehérjét kódol:
- RNS-függő RNS-polimeráz (L),
- nukleoprotein (N),
- foszforilált fehérje (P),
- mátrixfehérje (M) és
- külső felszíni glikoprotein (G).
Az N, P és L fehérjék a genomiális RNS-sel együtt alkotják a ribonukleoprotein komplexet. A G az egyetlen RV-antigén, amely képes RV-neutralizáló antitestek termelődését indukálni, amelyek a halálos RV-fertőzéssel szembeni fő immun effektorok. Másrészt a ribonukleoprotein komplexről kimutatták, hogy ez a fő RV-antigén, amely képes CD4+ T-sejtek indukálására, amelyek az intrastrukturális antigénfelismerésen keresztül fokozhatják az RV-neutralizáló antitestek termelődését.[ 2 ] A ribonukleoprotein komplex fontos szerepet játszhat az immunológiai memória és a hosszú távú immunitás kialakításában.[ 3 ]
Osztályozás és antigéntípusok
A Lyssavirus nemzetségbe tartozik a veszettség vírusa, valamint az antigén szempontjából és genetikailag rokon veszettség vírusok: a Lagos, a Mokola és a Duvenhage denevérvírusok, valamint az európai denevér-lyssavirusok két feltételezett altípusa. A keresztprotekciós vizsgálatok azt mutatják, hogy a hagyományos veszettség elleni vakcinákkal immunizált állatok nem feltétlenül védettek teljesen, ha más lyssavirusokkal fertőzik meg őket.
A veszettségvírusok fix (állatokban vagy sejtkultúrában történő átoltással adaptálódott) vagy utcai (vad típusú) vírusokra oszthatók. A monoklonális antitestek és a genetikai szekvenálás alkalmazása az utcai veszettségvírusok megkülönböztetésére segített azonosítani a világszerte található főbb gazdaszervezetekből származó vírusvariánsokat, és valószínűsíthető emberi expozíciós forrásokat sugallni olyan esetekben, amikor a beteg esetében egyébként nem volt egyértelmű állatharapás.[ 8 ]
Pathogenezis
A vadon élő állatok fertőzésének fő rezervoárja és forrása a farkasok, rókák, sakálok, denevérek, a háziállatok közül pedig a kutyák és macskák, ritkán a lovak, szarvasmarhák, sertések, patkányok stb. A fertőzés emberről emberre történő átvitele, bár lehetséges, rendkívül ritka. Ez egy tipikus zoonózisos fertőzés. Az emberek főként kutyáktól fertőződnek meg veszettséggel.
Miután egy embert megharap egy beteg állat, a vírus a csípés helyén lévő izomszövetben szaporodik, majd a perifériás érzőidegek végein centripetálisan terjed, elérve a motoros neuronokat. A vírus mozgásához és az agy érintettségéhez szükséges idő a csípés helyétől függ. Súlyos fej- és arccsípések esetén a vírus 15-20 nap alatt elérheti a központi idegrendszert, a törzs és a végtagok bőrének kisebb sérülése és ennek következtében a kórokozó kis dózisa esetén a vírus központi idegrendszerbe jutásának folyamata több hónappal, vagy akár 1-1,5 évvel is késhet. A központi idegrendszerbe jutva a vírus az agy és a gerincvelő szöveteiben rögzül, főként a nyúltvelő, az Ammon-szarv és az agyalapi mirigy neuronjaiban. A gerincvelőben a hátsó szarvak érintettek leginkább. A központi idegrendszerből a vírus centrifugálisan az idegtörzsek mentén jut el a nyálmirigyekbe, ahol szaporodik és a nyállal ürül ki.
A veszettség patogenezisének koncepciói
A RV széles gazdaszervezettel rendelkezik, és szinte minden emlőst megfertőzhet. Bár az RV-átvitel számos útját jelentették, a természetes fertőzés leggyakrabban harapás útján történik. A harapások mellett az RV-vel fertőzött tetemek fogyasztása elősegítheti a veszettségvírus-fertőzést a sarki rókáknál, és az RV nyálkahártyákkal való érintkezése egy másik lehetséges átviteli útnak bizonyult.[ 9 ] Bizonyos szokatlan körülmények között, például az RV véletlen aeroszol formájában történő kibocsátása laboratóriumban, vagy az RV aeroszol formájában történő kijutása nagyszámú denevér által lakott barlangokban,[ 10 ] előfordulhat aeroszolos átvitel.
Egyelőre nem világos, hogy az utcai RV-törzsek, valamint az egérhez adaptált vagy a szövettenyészethez adaptált RV-törzsek replikálódnak-e az inokuláció helyén, mielőtt bejutnának a központi idegrendszerbe. Míg fiatal hörcsögök vagy mosómedvék utcai RV-vel történő kísérleti intramuszkuláris fertőzése az RV replikációját mutatta ki a harántcsíkolt izomsejtekben, mielőtt a vírus behatolt volna a motoros neuronok axonjaiba a neuromuszkuláris csomópontokon keresztül,[ 11 ],[ 12 ] egerek intramuszkuláris fertőzése egérhez adaptált CVS-24 RV-vel kimutatta, hogy az RV közvetlenül a központi idegrendszerbe vándorol anélkül, hogy előzetesen replikálódna az inokuláció helyén.[ 13 ] Miután az RV a nem mielinizált axonok végződéseibe került, retrográd módon transzportálódik a sejttestbe.
A legújabb eredmények arra utalnak, hogy az axonális vezikulák transzportja kulcsfontosságú stratégiát jelenthet a virionok axonokban történő nagy távolságú mozgásához.[ 14 ] Becslések szerint a megfelelő vírus (RV) 3 mm/h sebességgel vándorol az axonokon belül.[ 15 ] A fertőzés ezután szinaptikus csomópontokkal összekötött neuronok láncolatán keresztül terjed. Azonban a transzszinaptikus terjedést elősegítő pontos mechanizmus még mindig ismeretlen. Az agy megfertőzése után a vírus centrifugálisan terjed a perifériás és az autonóm idegrendszerbe számos perifériás szervben.[ 16 ] A fertőzési ciklus utolsó szakaszában az RV a nyálmirigyekbe vándorol; a mukogén acinussejtekben történő replikáció után a nyálba szabadul, és készen áll a következő gazdaszervezetbe való átvitelre.[ 17 ]
A veszettség vírus által kiváltott patológiával kapcsolatban az apoptotikus sejthalált potenciális patogén mechanizmusként javasolták a kísérleti veszettség modellekben, amelyeket egy fix RV-törzzsel fertőzött egereken végeztek.[ 18 ] Egy patogén mechanizmus, amely hozzájárulhat a veszettségre jellemző súlyos központi idegrendszeri diszfunkcióhoz, a neuronális funkciók károsodása lehet. Kimutatták, hogy a génexpresszió jelentősen csökken az RV-fertőzött neuronokban, ami a fehérjeszintézis általános elnyomásához vezet,[ 19 ] és számos tanulmány kimutatta a neurotranszmisszió károsodását RV-fertőzést követően. Jiang kimutatta, hogy egy acetilkolin receptor antagonista kötődése a fertőzött patkány agyhomogenizátumokhoz csökkent a kontrollokhoz képest.[ 20 ] A szerotonin, az alvási ciklus, a fájdalomérzékelés és a viselkedés szabályozásában részt vevő neurotranszmitter felszabadulásának és kötődésének károsodását is megfigyelték RV-fertőzött patkány agyban.[ 21 ], [ 22 ] A neurotranszmisszió befolyásolása mellett a jobb kamrai fertőzés az ioncsatornákat is befolyásolhatja. A fertőzött egér neuroblasztóma sejtek a feszültségfüggő nátriumcsatornák csökkent funkcionális expresszióját mutatják, ami megakadályozhatja az akciós potenciálokat és végső soron funkcionális károsodáshoz vezethet.[ 23 ]
A központi idegrendszerben jelentkező súlyos kóros elváltozások hiánya mellett az emberi veszettség legtöbb esetben 7-10 nappal a klinikai tünetek megjelenése után sem vált ki immunválaszt. A veszettség és a legtöbb más vírusos vagy bakteriális központi idegrendszeri fertőzés patogenezise közötti jelentős különbségeket az a tény is alátámasztja, hogy az immunszuppresszió vagy hatástalan, vagy káros a veszettség kimenetelére.[ 24 ] A veszettség áldozatainál gyakran megfigyelt alacsony immunválasz rejtélyes, mivel nem magyarázható az RV-antigének gyenge immunogenitásával. Valójában az RV G és a nukleokapszid fehérje parenterálisan adagolva erős B- és T-sejt antigének.[ 25 ] Az RV elleni alacsony immunválasz egyik lehetséges magyarázata veszettségben szenvedő emberekben vagy állatokban az lehet, hogy a központi idegrendszer RV-fertőzése immunszuppressziót okoz, [ 26 ] és felmerült, hogy az RV egy felforgató stratégiát alkalmaz, amely magában foglalja az apoptózis megelőzését és a behatoló T-sejtek elpusztítását.[ 27 ]
A nem neuronális sejtekhez adaptálódott, attenuált RV-törzsek neuroinvazív jellegükben jelentősen különböznek a patogén utcai RV-törzsektől, ami arra utal, hogy képesek perifériás helyekről bejutni a központi idegrendszerbe. E tekintetben a szövettenyészethez adaptált RV-törzsek vagy nem, vagy csak korlátozottan képesek perifériás helyekről bejutni a központi idegrendszerbe, míg az utcai RV-törzsek vagy az egérhez adaptált RV-törzsek, mint például a CVS-24, rendkívül invazívak.[ 28 ] Az RV neuroinváziójában szerepet játszó kulcsfontosságú tényezők közé tartozik a vírusfelvétel, az axonális transzport, a transzszinaptikus terjedés és a vírusreplikációs ráta.
A közelmúltig az RV patogenezisével kapcsolatos ismereteink korlátozottak voltak, és elsősorban az utcai RV-törzsek leíró vizsgálatain vagy laboratóriumban adaptált, attenuált törzsekkel végzett kísérleti fertőzéseken alapultak. A reverz genetikai technológia megjelenése lehetővé tette számunkra, hogy azonosítsuk az RV patogén fenotípusát meghatározó virális elemeket, és jobban megértsük a veszettség patogenezisében szerepet játszó mechanizmusokat.
A veszettségvírus megszerzését, terjedését és replikációját szabályozó víruselemek azonosítása
- A vírus befogásában részt vevő víruselemek
Az RV-fertőzés a vírus feltételezett sejtreceptorhoz való kapcsolódásával kezdődik. Bár számos membránfelszíni molekulát javasoltak RV-receptorként, beleértve a nikotinsavas acetilkolin-receptort,[ 29 ] az idegsejt-adhéziós molekulát[ 30 ] és az alacsony affinitású neurotrofinreceptort, a p75 NTR-t,[ 31 ] még mindig nem világos, hogy ezek a molekulák valóban szerepet játszanak-e a veszettségvírus életciklusában. Ebben az összefüggésben a közelmúltban kimutatták, hogy az RV G–p75 NTR kölcsönhatás nem szükséges az elsődleges neuronok RV-fertőzéséhez.[ 32 ] A receptorhoz való kötődést követően az RV adszorpciós vagy receptor-közvetített endocitózissal internalizálódik.[ 33 ] Az endoszomális rekeszen belüli alacsony pH-jú környezet ezután konformációs változásokat indukál az RV G-ben, amelyek kiváltják a vírusmembrán fúzióját az endoszomális membránnal, ezáltal felszabadítva az RNP-t a citoplazmába.[ 34 ] A vírusok esetében az RV G kritikus szerepet játszik a vírusfelvételben, valószínűleg a feltételezett sejtreceptorokkal való kölcsönhatásokon keresztül, amelyek elősegítik a gyors felvételt. E tekintetben kimutatták, hogy a szövettenyészethez adaptált RV-törzsek (pl. ERA, HEP és CVS-11) patogenitása korrelál a G-fehérje III. antigénhelyén található determináns jelenlétével. [ 35 ] Az ERA G-fehérje ezen antigénhelyének 333. pozíciójában bekövetkező Arg → Gln mutáció a Gln333 RV-variáns internalizációjában hétszeres késleltetést eredményezett a vad típusú variánshoz képest. Az RV G Asn194→Lys194 mutációja, amely a patogén fenotípus újbóli megjelenését magyarázza, az internalizációs idő jelentős csökkenésével járt együtt.[ 36 ] Továbbá, kiméra RV-kkel végzett kísérletek azt mutatták, hogy az RV virionok internalizációjához szükséges idő jelentősen megnőtt, a patogenitás pedig erősen csökkent, miután a magas patogenitású SB RV törzs G génjét – amely az ezüstből származó, denevérekkel kapcsolatos RV-18 törzs cDNS klónjából származott –[ 37 ] a magas patogenitású SN törzs génjével helyettesítették, amelyet az SAD B19 RV vakcinatörzs cDNS klónjából izoláltak.[ 38 ] Ezek az adatok együttesen alátámasztják azt a feltételezést, hogy a vírusfelvétel kinetikája, amely az RV G függvénye, az RV patogenitásának fő meghatározója.
- A vírusok terjedésében és átvitelében részt vevő víruselemek
A veszettségvírus egyedülálló tulajdonsága, hogy képes sejtről sejtre terjedni. Az a megfigyelés, hogy a Gln333 ERA variáns in vitro elveszíti pH-függő sejt-sejt fúziós aktivitását [ 39 ], és jelentősen csökkent sejtről sejtre terjedési képességet mutat [ 40 ], arra utal, hogy az RV G szintén kulcsszerepet játszik a sejtek közötti terjedésben, és így a vírusátvitelben, valószínűleg fúziós aktivitása révén. Ezt a lehetőséget tovább alátámasztja az a megállapítás, hogy a patogén RV revertáns SPBNGAK terjedési sebessége majdnem kétszer olyan magas, mint a nem patogén SPBNGAK variánsé. Érdekes módon az Asn 194 → Lys 194 mutáció a G SPBNGAK-ban a membránfúzió pH-küszöbének magasabb pH-értékre való eltolódását okozta, ami alátámasztja azt a hipotézist, hogy a membránfúzió magasabb pH-küszöbértéke a vírus fokozott terjedésével jár. [ 41 ]
Az RV-fertőzés transzneuronális indikátorainak vizsgálata patkányokban [ 42 ] és rhesusmajmokban [ 43 ] kimutatta, hogy a veszettség vírusa kizárólag retrográd irányban vándorol az axonokban. Bár számos RV-fehérje részt vesz a neuronális transzportmechanizmusokban, úgy tűnik, hogy az RV G domináns szerepet játszik az RV-fertőzés transzneuronális terjedésében. Például, míg az RV G-vel pszeudotipizált ló fertőző vérszegénység vírusával (EIAV) történő perifériás fertőzés a vírus gerincvelőbe történő átvitelét eredményezi, ugyanaz az EIAV, amelyet vezikuláris sztomatitisz vírus G-vel pszeudotipizáltak, nem jutott be az idegrendszerbe. [ 44 ] Továbbá az ERA G Arg 333 → Gln 333 mutáns központi idegrendszeri terjedése erősen csökkentnek bizonyult a vad típusú mutánshoz képest, ami tovább sugallja az ép RV G funkcióját a transzszinaptikus terjedésben. Azonban az RV G transzszinaptikus transzportban betöltött fontos szerepére vonatkozó legmeggyőzőbb bizonyíték egerek rekombináns G-hiányos RV vírussal történő intrakraniális fertőzéséből származik, amely kimutatta, hogy a fertőzés a beoltás helyén lévő neuronokra korlátozódott, a másodlagos neuronokra való terjedés bizonyítéka nélkül.[ 45 ] Valószínű azonban, hogy az RV G mellett az RV M is szerepet játszik a vírus terjedésében, és így a transzszinaptikus transzportban is. E tekintetben kimutatták, hogy a kiméra SN-BMBG RV variáns terjedése, amely mind az M-et, mind a G-t tartalmazza a magas patogenitású SB-ből, szignifikánsan nagyobb volt, mint a kiméra SN-BG vagy SN-BM variáns terjedése, amelyek az SB G-jét és M-jét tartalmazzák, ami arra utal, hogy az M és a G optimális kölcsönhatása fontos szerepet játszhat a sejtről sejtre terjedő vírusban. [ 46 ] Mivel az RV M támogatja a vírus sarjadását, [ 47 ] valószínű, hogy az RV SN-BMBG kiméra variáns hatékonyabb terjedése a posztszinaptikus membránon történő optimális vírus sarjadásának köszönhető.
Újabb tanulmányok kimutatták, hogy az RV P és a dynein könnyűlánc közötti kölcsönhatás összekapcsolja az RV RNP-t a gazdasejt transzportrendszerével, ezáltal elősegítve a vírus retrográd axonális transzportját.[ 48 ],[ 49 ] Felnőtt egerek perifériás fertőzése azonban azt mutatta, hogy az RV P LC8 kötő doménjének deléciója nem akadályozza meg a vírus bejutását a központi idegrendszerbe, ami arra utal, hogy az RV fehérje nem vesz közvetlenül részt az RV retrográd axonális terjedésében.[ 50 ]
- Vírusreplikációt szabályozó víruselemek
Sok más vírussal, például az influenzavírussal ellentétben az RV patogenitása fordítottan arányos a vírus RNS-szintézisének és a fertőző vírusrészecskék termelésének sebességével. A különböző kiméra vírusok által termelt vírus mRNS és genomiális RNS szintjének összehasonlítása arra utal, hogy a vírus RNS transzkripcióját és replikációját több tényező szabályozza, beleértve az RV M-et is, amelyet transz-ható faktorként azonosítottak, amely közvetíti az mRNS-szintézis kezdeti magas szintjéről a genomiális RNS-szintézisre való átállást.[ 51 ] Továbbá, az összes rabdovírusból származó M képes leállítani a vírusgén expresszióját az RNP-hez kötődve, ami egy erősen kondenzált, gerincszerű szerkezet kialakulásához vezet, amely nem képes támogatni az RNS-szintézist.
A vírusreplikáció szabályozásával a patogenitást szabályozó egyéb virális elemek azonosítása érdekében a magas patogenitású SB törzs 5'-terminális szekvenciáit lépésenként lecserélték a magas patogenitású SN vakcinatörzs szekvenciáira, így rekombináns SB2 (terminális szekvencia [TS] + L), SB3 (TS + L + pszeudogén [Ψ]), SB4 (TS + L + Ψ + G) és SB5 (TS + L + Ψ + G + M) vírusokat eredményeztek. Az SB és SN parentális vírusokkal, valamint a kiméra SB2, SB3, SB4 és SB5 RV-kkel végzett intramuszkuláris fertőzés a legmagasabb mortalitási arányt eredményezte az SB-fertőzött egerekben, míg az SN-fertőzött egerekben nem tapasztaltak morbiditást vagy mortalitást. A TS, L és SB helyettesítése az SN megfelelő elemeivel a morbiditás és a mortalitás szerény csökkenését eredményezte, és egy további G vagy G plusz M csere erősen csökkentette vagy teljesen megszüntette a vírus patogenitását.
Ezen vad típusú és kiméra RV-k fenotípusos jellemzése szövettenyészetben kimutatta, hogy egy adott RV patogenitása fordítottan arányos a neuronális sejtekben való replikációs képességével. Bár az SB közel 1000-szer alacsonyabb szinten replikálódott, mint az SN, és a TS, L és az SB-ben lévő géneknek SN-szinttel való helyettesítése csekély hatással volt a vírusnövekedés kinetikájára, az SB G vagy G plusz M génjeinek további helyettesítése a megfelelő SN génekkel 1 log-os növekedést eredményezett a vírustermelésben, ami arra utal, hogy a vírus RNS replikációs kinetikáját, valamint a vírusrészecskék termelését nagymértékben az RV G fehérje szabályozza. Ezt a következtetést alátámasztják azok az RV G variánsokkal kapott adatok, amelyek G fehérjéiben egy aminosavban különböznek. A patogén veszettségvírus-variáns SPBNGAK 194 olyan vírustitert termelt az NA sejtekben, amely 1 log-dal alacsonyabb volt, mint a nem patogén variáns SPBNGAK 194 által termelt titer, és a valós idejű PCR-analízis kimutatta, hogy a vírus RNS-transzkripciójának és replikációjának sebessége az SPBNGAK-kal fertőzött NA sejtekben 5-, illetve 10-szer magasabb volt, mint az SPBNGAK-kal fertőzött NA sejtekben.[ 52 ] További bizonyítékot szolgáltattak a patogenitás és a vírus RNS-szintézis, valamint a vírusrészecske-termelés sebessége közötti fordított korrelációra azok az egerek, amelyeket kiméra rekombináns vírusokkal fertőztek meg, amelyekben a legyengített SN törzs G és M génjeit a magas patogenitású SB törzs génjei helyettesítették. Ezek a kísérletek a szülői SN törzs patogenitásának jelentős növekedését mutatták ki az RV G-t hordozó törzshöz képest. A patogenitás tovább fokozódott, amikor mind a G, mind az M gént az SB-ből bevitték az SN-be.
A G vagy M, vagy mindkettő SN-ben történő helyettesítése az SB megfelelő génjeivel a vírusrészecskék termelésének, valamint a vírus RNS-szintézis sebességének jelentős csökkenésével járt együtt. Ezek az adatok azt mutatják, hogy mind a G, mind az M fontos szerepet játszik az RV patogenezisében a vírusreplikáció szabályozásával. Az a megállapítás, hogy a G vagy G plusz M SN-ben történő helyettesítése G-vel vagy G plusz M-mel az SB-ben a vírus RNS-transzkripciójának és replikációjának mérsékelt vagy erős csökkenését eredményezi, míg az M önmagában történő helyettesítése az SN-ben az SB M-jével a vírus RNS-transzkripciójának és replikációjának erős növekedését eredményezi, azt jelzi, hogy az RV G-nek is fontos szabályozó funkciója van a vírus RNS-transzkripciójában/replikációjában, akár önmagában, akár az M fehérjével való kölcsönhatás révén. Az a mechanizmus, amellyel az RV G gén szabályozza a vírus RNS-szintézist, ismeretlen. Az RV G géneken belüli bizonyos nukleotidszekvenciákat, például az Arg333 és Lys 194 kodonjait tartalmazókat, a sejtes miRNA-k célpontjaiként azonosították. Kimutatták, hogy a sejtes miRNA-k általi célpontfelismerés a vírusreplikáció pozitív vagy negatív szabályozását eredményezheti. [ 53 ] Az RV G génszekvencián belüli Arg 333 → Glu 333 vagy Lys 194 → Ser 194 szubsztitúciók a miRNA célszekvenciák eltűnését eredményezik, ami viszont a vírusos RNS-szintézis sebességének jelentős növekedésével jár [Faber M, Thomas Jefferson Egyetem, PA, USA, Kiadatlan adatok], ami arra utal, hogy a gazdasejt miRNA-i szintén fontos szerepet játszanak az RV replikációjának szabályozásában, ahogyan azt más RNS-vírusok, köztük a vezikuláris sztomatitisz vírus és a HCV esetében is kimutatták. [ 54 ], [ 55 ]
Úgy tűnik, hogy a vírusreplikáció szabályozása az RV patogenezisében szerepet játszó egyik fontos mechanizmus. Az immunválasz elkerülése és a neuronális hálózat integritásának megőrzése érdekében a patogén RV-törzsek, de nem attenuált törzsek, szabályozhatják növekedési sebességüket. Az alacsonyabb replikációs sebesség valószínűleg a patogén RV-törzsek javát szolgálja, mivel megőrzi azt a neuronális struktúrát, amelyet ezek a vírusok a központi idegrendszer elérésére használnak. A patogén RV alacsonyabb replikációs sebességének egy másik magyarázata az, hogy a gazdaszervezet immunrendszere általi korai felismerés elkerülése érdekében a vírus minimális szinten expressziós szinten tartja antigénjeit.
Az RV G expresszió, az apoptózis és a patogenitás közötti kapcsolat
Közismert, hogy az utcai veszettségvírus-törzsek, amelyek szignifikánsan patogénebbek, mint a szövettenyészethez adaptált törzsek, nagyon korlátozott mennyiségű G-t expresszálnak, és csak a fertőzési ciklus késői szakaszában indukálnak apoptózist, ami arra utal, hogy egy adott vírustörzs patogenitása fordítottan arányos az RV G expressziójával és az apoptózis indukálásának képességével.[ 56 ] A rekombináns RV SPBNGA-GA-val, amely két azonos G gént hordozott és túltermelte az RV G-t, közvetlen bizonyítékot kaptak a G expresszió szintje és az apoptózis mértéke közötti korrelációra.[ 57 ] Az ezzel a rekombináns RV-vel fertőzött neuronális tenyészetek morfológiai vizsgálata azt mutatta, hogy a sejthalál szignifikánsan megnőtt az RV G túltermelésével párhuzamosan, és hogy az apoptózis az RV G által közvetített halálban részt vevő fő mechanizmus. Különösen az F-aktin festődés csökkenése az SPBNGA-GA fertőzés után összhangban van az aktin filamentumok apoptózis által kiváltott depolimerizációjával. Továbbá a TUNEL-pozitív sejtmagok száma az SPBNGA-GA-val fertőzött neuronokban szignifikánsan megnőtt a nem fertőzött és az SPBNGA-val fertőzött neuronokban lévő sejtekhez képest. Azonban az RV G gén apoptotikus jelátviteli folyamatban közvetítő mechanizmusa nagyrészt ismeretlen. Felmerült, hogy egy bizonyos küszöbérték feletti RV G expresszió súlyosan károsítja a sejtmembránt. Nagyon valószínű, hogy az apoptotikus sejtek nem tisztulnak ki gyorsan a központi idegrendszerben, és ezért másodlagos nekrózison mennek keresztül. [ 58 ] Másrészt az RV-fertőzés, és különösen az RV G fehérje túltermelése piroptózishoz vezethet, amely egy az apoptózishoz hasonló sejthalálút, amely – az apoptózissal ellentétben – a kaszpáz 1 aktiválódását foglalja magában, és ezáltal nekrózishoz vezet. [ 59 ] Az RV-fertőzés által kiváltott nekrózis vagy piroptózis mértéke valószínűleg kritikus szerepet játszik az antivirális immunitás indukciójában. Míg az apoptotikus sejtek megőrzik membránjuk integritását, és nem stimulálják a veleszületett immunválaszt, a nekrotikus sejtek permeabilizálódnak, és endogén adjuvánsokat választanak ki, amelyek erős veleszületett immunválaszt válthatnak ki. [ 60 ]
Mivel az apoptózis/nekrózis szintje korrelál az RV immunogenitásával, felmerült, hogy az apoptotikus/nekrotikus sejtek immunstimuláló hatása valószínűleg hozzájárul a védő immunválasz kialakulásához. Ezért az RV G expressziójának szabályozása nagy valószínűséggel fontos tényező a veszettség patogenezisében, mivel lehetővé teszi a patogén RV-variánsok túlélését és terjedését az idegrendszerben anélkül, hogy nyilvánvaló neuronális károsodást okozna, és védő immunválaszt váltana ki, amely megelőzné a fertőzést.
Az RV G expressziója szabályozható az RNS-szintézis szintjén, a poszttranszlációs szinten, vagy mindkettőn. Kimutatták, hogy a különböző RV kiméra variánsok által expresszált RV G szintje tükröződik a vírus RNS-szintézis sebességében, ami arra utal, hogy az RV G expressziójának eltérő szabályozása ezen variánsok által a vírus mRNS transzkripciójának sebességének változásaiból ered. A vírus RNS transzkripciós sebességéhez hasonlóan az ezen variánsok által expresszált RV G mennyisége fordítottan arányos a vírus patogenitásával. Másrészt a primer neuronális tenyészetek kevésbé patogén RV variánssal, a CVS-B2c-vel történő fertőzése négyszer magasabb G-fehérje szintet eredményezett, mint a magas patogenitású CVS-N2c variánssal történő fertőzés, annak ellenére, hogy mindkét fertőzésben hasonló szintű G mRNS szintézis történt. A pulzáló kísérletek azt mutatták, hogy a CVS-B2c-vel fertőzött neuronokban a magasabb G-fehérje szintek nagyrészt a CVS-B2c G-fehérje alacsonyabb lebontási sebességének az eredménye a CVS-N2c G-fehérjéhez képest. Azonban a CVS-N2c G-fehérje gyorsabb proteolitikus lebomlásához vezető mechanizmus még tisztázásra vár.
Tünetek veszettség
A veszettség lappangási ideje átlagosan 30-90 nap. A fej és az arc nagy sebein keresztül történő tömeges fertőzés esetén ez 12 napra lerövidülhet. Ritka esetekben a lappangási idő 1 évig vagy tovább is tarthat.
A betegség három periódusának szigorúan egymást követő változása van: prodromális, gerjesztési, bénulási.
A prodromális időszak a csípés helyén jelentkező sajgó vagy húzó fájdalommal, valamint az idegek mentén jelentkező fájdalommal kezdődik. A heg területén égő érzés, viszketés, néha bőrpír és duzzanat jelentkezhet. A beteg általános rossz közérzetet, fejfájást, hányingert tapasztal. Hányás, a testhőmérséklet 37,5-38 °C-ra emelkedése, valamint progresszív mentális zavar tünetei jelentkeznek: fokozott reflex ingerlékenység, megmagyarázhatatlan szorongás, félelem, melankólia. A beteg gyakran depressziós, gátlásos, visszahúzódó, nem hajlandó enni, rosszul alszik, komor gondolatokra, ijesztő álmokra panaszkodik. A prodromális időszak 2-3 napig tart, néha 7 napig is elnyúlhat. Ezen időszak végén szorongásos rohamok jelentkezhetnek rövid távú légzési nehézségekkel, mellkasi szorító érzéssel, tachycardiával és fokozott légzéssel.
Az izgalmi időszakot a hidrofóbia megjelenése jellemzi: ivás közben, majd a víz látványára vagy annak emlékeztetésére a beteg garat- és gégegörcsöt tapasztal, melynek során sikolysal elhajítja a vízzel teli bögrét, remegő kézzel előrehajítja, fejét és testét hátraveti. A nyak kinyúlik, fájdalmas grimasz torzítja az arcot, amely a légzőizmok görcse miatt kékessé válik. A szemek kidüllednek, félelmet fejeznek ki, segítségért könyörögnek, a pupillák kitágulnak, a belégzés nehézkes. A roham tetőpontján szív- és légzésleállás is előfordulhat. A roham több másodpercig tart, ezután a beteg állapota látszólag javul. Ezt követően a gége- és garatizmok görcsrohamai akár levegő mozgására (aerofóbia), erős fényre (fotofóbia) vagy hangos szóra (akusztikofóbia) is felléphetnek. A rohamokat pszichomotoros izgatottság kíséri, melynek során a beteg „őrültként” viselkedik. A roham alatt az eszmélet elhomályosul, de az interiktális időszakban kitisztul. Az izgatottság időszakában a szimpatikus idegrendszer fokozott tónusa miatt a betegeknél hirtelen megnő a nyáltermelés (sialorrhoea), a garatizmok görcse miatt képtelenség a nyál lenyelésére. A beteg nyállal permetez. Egyes betegeknél meningizmus, sőt opisthotonus jelei is jelentkezhetnek, és gyakoriak a görcsök. Ebben az esetben az agy-gerincvelői folyadék nem változhat, de egyes betegeknél a fehérjekoncentráció megnőhet, és a sejtek száma megnőhet a limfociták miatt.
Megfelelő kezelés nélkül a kiszáradás jelei fokozódnak, az arcvonások élesebbé válnak, a testsúly csökken. A testhőmérséklet magas értékekre emelkedik. Görcsök előfordulhatnak. Az izgalmi stádium időtartama körülbelül 2-3 nap, ritkán 4-5 nap. A halálos kimenetel általában az egyik roham alatt következik be. Ritkán a beteg túléli a betegség harmadik stádiumát.
A bénulás ideje alatt a beteg megnyugszik. A hidrofóbia rohamai megszűnnek, a beteg tud inni és nyelni, eszmélete tiszta. A látszólagos jólét ellenére azonban hamarosan fokozódik a letargia, az apátia, a depresszió, végtagbénulás, kismedencei zavarok, az agyidegek bénulása jelentkezik. A testhőmérséklet 42-43 °C-ra emelkedik, a vérnyomás csökken, és az első nap végére a szív- és érrendszeri, valamint a légzőközpontok bénulása miatt halál következik be.
A perifériás vérben neutrofil leukocitózis, megnövekedett hemoglobin, eritrociták és hematokrit figyelhető meg.
Mi bánt?
Forms
Klinikailag típusos és atípusos formákat különböztetünk meg. Az atípusos formák közé tartozik minden olyan eset, amelyben nincsenek izgalmi állapotok és hidrofóbia. Az atípusos formák közé tartozik a bulbáris, a cerebelláris, a meningoencephalitikus stb.
Diagnostics veszettség
A veszettség diagnózisát a veszettség elleni antigén, antitestek, vírus RNS vagy vírus izolálás kimutatása teszi lehetővé. Mivel bármely teszt negatív lehet egy veszettségben szenvedő betegnél, néha sorozatos szérummintákra van szükség a veszettség elleni antitestek kimutatására, nyálmintákra a vírustenyésztéshez, és bőrbiopsziára a vírusantigén közvetlen immunfluoreszcens vizsgálatához, különösen akkor, ha a veszettség gyanúja erős.
Az emberben a halál előtti veszettség diagnosztizálásának egyik leggyorsabb módszere a tarkóról vett bőrbiopszián végzett közvetlen immunfluoreszcens teszt a veszettség antigénjének kimutatására. A közvetlen immunfluoreszcens teszt a legérzékenyebb és legspecifikusabb módszer a veszettség antigénjének kimutatására bőrben és más friss szövetekben (pl. agybiopszia), bár az eredmények a betegség korai szakaszában esetenként negatívak lehetnek. Ha friss szövet nem áll rendelkezésre, a fixált szövetek enzimatikus emésztése növelheti az immunfluoreszcens teszt reaktivitását; azonban az érzékenység elfogadhatatlanul alacsony lehet.
A diagnózis akkor is felállítható, ha a vírust neuroblasztóma sejtek vagy laboratóriumi rágcsálók beoltása után nyálból izolálják; ez általában a betegség első 2-3 hetében a leghatékonyabb. A veszettség vírusát neutralizáló antitestek kimutatása a be nem oltott egyének szérumában, amelyet általában a gyors fluoreszcens fókuszgátlási teszttel (RFFIT) végeznek, szintén diagnosztikai jellegű. Az antitestek jelenléte az agy-gerincvelői folyadékban megerősíti a diagnózist, de ezek 2-3 nappal később jelenhetnek meg, mint a szérum antitestek, ezért kevésbé hasznosak lehetnek a betegség korai szakaszában. Míg a vakcinációt követő szerológiai válasz általában megkülönböztethetetlen a betegség által kiváltott szerológiai választól, a vakcináció általában nem termel antitesteket az agy-gerincvelői folyadék ellen.
Az elmúlt 25 évben mindössze hét veszettségből „felépülés” esetét dokumentálták jól. Bár a betegek közül egyikből sem izoláltak veszettségvírust, a szérummintákban található magas titerű veszettség-neutralizáló antitestek és a cerebrospinális folyadékban található neutralizáló antitestek jelenléte erősen alátámasztotta a diagnózist.
Mit kell vizsgálni?
Milyen tesztekre van szükség?
Megkülönböztető diagnózis
Az emberi veszettség diagnózisát általában epidemiológiai és klinikai adatok alapján állítják fel, és laboratóriumban igazolják. A diagnózis egyszerű, ha a kórtörténetben szerepel állatharapás, és a tünetek és jelek teljes spektruma előfordult. Ellenkező esetben a kevésbé tipikus esetek epidemiológiai és klinikai jellemzőinek gondos, de gyors értékelése szükséges a specifikus laboratóriumi vizsgálatok elvégzése előtt. Minden neurológiai tünetekkel vagy megmagyarázhatatlan encephalitisszel rendelkező beteget meg kell kérdezni a lakóhely szerinti országon belüli vagy kívüli veszettség-endémiás területeken élő állatokkal való érintkezés lehetőségéről. Az, hogy az Egyesült Államokban a közelmúltban több emberi halálesetben sem gyanakodtak a veszettségre, valószínűleg a gondos expozíciós kórelőzmény hiányának tudható be.
A betegség kezdetén a veszettség számos fertőző és nem fertőző betegséget utánozhat. Sok más agyvelőgyulladás, például a herpeszvírusok és arbovírusok által okozottak, hasonlítanak a veszettségre. Más fertőző betegségek is utánozhatják a veszettséget, például a tetanusz, az agyi malária, a rickettsiózis és a tífusz. A veszettséggel összetéveszthető bénulásos fertőző betegségek közé tartozik a gyermekbénulás, a botulizmus és a herpes simian B agyvelőgyulladás.
A veszettséggel összetéveszthető nem fertőző betegségek közé tartozik számos neurológiai szindróma, különösen az akut gyulladásos polyneuropathia (Guillain-Barré-szindróma), valamint az idegszövet veszettség elleni oltása után kialakuló allergiás posztvakcinációs agyvelőgyulladás, mérgezés vagy gyógyszer-intoxikáció, alkoholmegvonás, akut porfíria és veszettség hisztéria. A Guillain-Barré-szindróma összetéveszthető a bénulásos veszettséggel, és fordítva.
Ki kapcsolódni?
Kezelés veszettség
A veszettség kezelésére még nem fejlesztettek ki módszereket. A specifikus veszettség elleni immunglobulin és a leukocita interferon nagy dózisú beadása hatástalan. A beteg szenvedésének enyhítésére tüneti kezelést alkalmaznak. Ennek érdekében a beteget külön kórterembe vagy dobozba helyezik, és védőrendszert hoznak létre, amely korlátozza a külső környezet hatását (csökkent zaj, erős fény, légáramlás). A központi idegrendszer ingerlékenységének csökkentése érdekében altatókat, görcsoldókat és fájdalomcsillapítókat írnak fel. A vízháztartás normalizálódik.
A bénulásos stádiumban olyan gyógyszereket írnak fel, amelyek stimulálják a szív- és érrendszer, valamint a légzőrendszer aktivitását. Ajánlott hiperbárikus oxigénellátást, agyi hipotermiát, szabályozott mechanikus légzést alkalmazni a beteg teljes gyógyításával. Azonban minden kezelési módszer gyakorlatilag hatástalan. A legjobb esetben a beteg életét több hónappal is meg lehet hosszabbítani. A kedvezőtlen kimenetelt az agytörzs károsodásának súlyossága határozza meg, a létfontosságú központok pusztulásával.
Megelőzés
Pasteur 1885-ben kifejlesztette az első veszettség elleni vakcinát, amely a sokkal hatékonyabb veszettség elleni védekezés korszakát nyitotta meg. Ma, annak ellenére, hogy az embereknél a veszettség közel 100%-os halálozási arányt mutat, a betegség teljes mértékben megelőzhető a fertőzés előtti és/vagy utáni oltással. Míg Pasteur és kollégái kezdeményezték a magánkutyák oltását Párizsban, a kutyák első tömeges oltását az 1920-as évek elején végezték el Japánban, ami az első jelentős nemzeti veszettség elleni védekezési programot jelentette. A vadon élő állatok orális oltásáról, amelyet először az 1970-es években fejlesztettek ki, azóta ismételten kimutatták, hogy hatékonyan kontrollálja a betegséget a főbb szárazföldi gazdaállatokban, például a rókákban, mosómedvékban és bűzösborzokban.[ 68 ] A rezervoár állatpopulációk 70%-os vagy magasabb lefedettségi arányú tartós veszettség elleni oltása végül kiküszöböli a RABV-t a rezervoár fajokból, és megakadályozza a vírus terjedését a véletlen gazdákra.[ 69 ]
A filogenetikai adatok azt mutatják, hogy a lyssavírusok jóval a szárazföldi emlősök megfertőzése előtt megfertőzték a denevéreket, és a legtöbb lyssavírus, beleértve a RABV-t is, még mindig kering a denevérfajokban világszerte.[ 70 ] A RABV denevérek közötti átvitelének megakadályozására szolgáló hatékony módszerek azonban továbbra sem állnak rendelkezésre, ami kizárja a veszettség teljes felszámolásának lehetőségét. Azonban még egy veszettséggel fertőzött emlős harapása révén a RABV-nek való kitettség után is, a biztonságos és hatékony posztexpozíciós profilaxis (PEP, beleértve a sebtisztítást, a veszettség elleni immunglobulint és a veszettség elleni oltást) megvédheti az embereket a veszettségfertőzéstől, ha a kezelést azonnal és az Egészségügyi Világszervezet (WHO) ajánlásainak megfelelően alkalmazzák.
Az emberi halálesetek megelőzésének e két módszere – az egyik a kitett emberek beoltásán, a másik pedig azon, hogy elegendő kutyát oltsanak be ahhoz, hogy a forrásnál megtörjék az átviteli ciklust – a kutyák veszettségének megelőzésére és leküzdésére irányuló „egy egészségügyi” megközelítés alapkövei. Az emberi halálesetek megelőzésének e két különböző eszközét külön alternatívaként vizsgálták: az A stratégiát, amely a PEP biztosítására épült, és a B stratégiát, amely a kutyák beoltására épült; vagy az A + B stratégia kombinált összetevőiként az alternatív stratégiák valószínűsíthető költségeinek elemzésében.[ 71 ]
Az olyan országok, mint Thaiföld, hatalmas sikereket értek el az emberi halálesetek megelőzésében a PEP használatával, de a PEP önmagában történő alkalmazásával kapcsolatos növekvő keresletet és a kapcsolódó költségeket is tapasztalták. [ 72 ] Például 2003-ban az 1991-es helyzethez képest négyszer annyi embernek (több mint 400 000-nek) volt szüksége PEP-re. A legfrissebb adatok azt mutatják, hogy a Kínai Népköztársaság, amely évente 15 millió embert olt be a veszettség esetleges kitettsége után, évente körülbelül 650 millió USD-t költ csak PEP-re. [ 73 ]
Sokkal fenntarthatóbb megközelítés a fertőzés terjedésének megakadályozása a forrásnál, az állatpopulációban, miközben szükség esetén javítjuk a PEP-hez való hozzáférést a fertőzésnek kitett emberi betegek számára. Ahol van politikai akarat és megfelelő finanszírozás a kutyák veszettségének ellenőrzésére, a halálos kimenetelű esetek kiküszöbölhetők és ki is küszöbölhetők. A kutyák vakcinázásának széles körű alkalmazása a kutyák veszettségének több országban történő felszámolásához vezetett, köztük Malajziában 1954-ben [ 74 ], Japánban 1956-ban, Tajvanon 1961-ben, Szingapúrban és különösen Nyugat-Európában (áttekintés Rupprecht és munkatársai, King és munkatársai, valamint Gongal és Wright munkáiban). [ 75 ]
Использованная литература


 [
[