A cikk orvosi szakértője
Új kiadványok
A katekolaminok szintézise, szekréciója és metabolizmusa
Utolsó ellenőrzés: 06.07.2025

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
A mellékvesevelő olyan vegyületeket termel, amelyek szerkezete távol áll a szteroidoktól. Ezek egy 3,4-dihidroxifenil (katekol) magot tartalmaznak, és katekolaminoknak nevezik őket. Ezek közé tartozik az adrenalin, a noradrenalin és a dopamin-béta-hidroxitiramin.
A katekolamin szintézisének sorrendje meglehetősen egyszerű: tirozin → dihidroxifenilalanin (DOPA) → dopamin → noradrenalin → adrenalin. A tirozin táplálékkal jut be a szervezetbe, de fenilalaninból is képződhet a májban fenilalanin-hidroxiláz hatására. A tirozin átalakulásának végtermékei a szövetekben eltérőek. A mellékvesevelőben a folyamat az adrenalin képződésének szakaszába, a szimpatikus idegek végződéseiben a noradrenalin képződésébe, a központi idegrendszer egyes neuronjaiban a katekolaminok szintézise dopamin képződésével végződik.
A tirozin DOPA-vá történő átalakulását a tirozin-hidroxiláz katalizálja, amelynek kofaktorai a tetrahidrobiopterin és az oxigén. Úgy vélik, hogy ez az enzim korlátozza a katekolamin-bioszintézis teljes folyamatának sebességét, és a folyamat végtermékei gátolják. A tirozin-hidroxiláz a katekolamin-bioszintézisre gyakorolt szabályozó hatások fő célpontja.
A DOPA dopaminná alakulását a DOPA-dekarboxiláz enzim katalizálja (kofaktor - piridoxál-foszfát), amely viszonylag nem specifikus, és más aromás L-aminosavakat dekarboxilez. Vannak azonban arra utaló jelek, hogy a katekolaminok szintézise módosítható ezen enzim aktivitásának megváltoztatásával. Egyes neuronokból hiányoznak a dopamin további átalakításához szükséges enzimek, és ez a végtermék. Más szövetek dopamin-béta-hidroxilázt tartalmaznak (kofaktorok - réz, aszkorbinsav és oxigén), amely a dopamint noradrenalinné alakítja. A mellékvese velőjében (de nem a szimpatikus idegek végződéseiben) feniletanol-amin található - egy metiltranszferáz, amely noradrenalinból adrenalint képez. Ebben az esetben az S-adenozil-metionin metilcsoportok donoraként szolgál.
Fontos megjegyezni, hogy a feniletanolamin-N-metiltranszferáz szintézisét a velőbe a kéregből a portális vénás rendszeren keresztül jutó glükokortikoidok indukálják. Ez magyarázhatja azt a tényt, hogy két különböző endokrin mirigy egyesül egy szervben. A glükokortikoidok fontosságát az adrenalin szintézise szempontjából hangsúlyozza az a tény, hogy a mellékvesevelő noradrenalint termelő sejtjei az artériás erek körül helyezkednek el, míg az adrenalint termelő sejtek főként a mellékvesekéregben található vénás sinusokból kapják a vért.
A katekolaminok lebomlása főként két enzimrendszer hatására történik: a katekol-O-metiltranszferáz (COMT) és a monoamin-oxidáz (MAO). Az adrenalin és noradrenalin lebontásának fő útvonalait az 54. ábra vázlatosan mutatja. A COMT hatása alatt, a metilcsoport-donor S-adrenozil-metionin jelenlétében a katekolaminok normetanefrinné és metanefrinné (a noradrenalin és az adrenalin 3-O-metil-származékai) alakulnak, amelyek a MAO hatására aldehidekké, majd (aldehid-oxidáz jelenlétében) vanilil-mandulasavvá (VMA), a noradrenalin és az adrenalin fő bomlástermékévé alakulnak. Ugyanebben az esetben, amikor a katekolaminok kezdetben MAO-nak, és nem COMT-nek vannak kitéve, 3,4-dioxo-mandulaaldehiddé, majd az aldehid-oxidáz és a COMT hatása alatt 3,4-dioxo-mandulasavvá és VMC-vé alakulnak. Alkohol-dehidrogenáz jelenlétében a katekolaminokból 3-metoxi-4-oxifenilglikol képződhet, amely az adrenalin és noradrenalin központi idegrendszeri lebomlásának fő végterméke.
A dopamin lebomlása hasonló, azzal a különbséggel, hogy metabolitjaiból hiányzik a hidroxilcsoport a béta-szénatomon, ezért a vanilil-mandulasav helyett homovanillinsav (HVA) vagy 3-metoxi-4-hidroxi-fenilecetsav keletkezik.
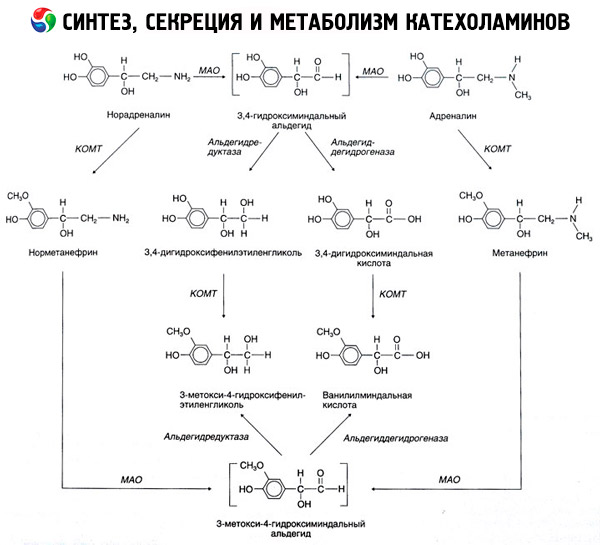
A katekolamin molekula oxidációjának kinoid útvonala is létezik, amely kifejezett biológiai aktivitással rendelkező köztes termékeket eredményezhet.
A szimpatikus idegvégződésekben és a mellékvesevelőben citoszolikus enzimek hatására képződő noradrenalin és adrenalin bejut a szekréciós granulumokba, ami megvédi azokat a lebontó enzimek hatásától. A katekolaminok granulátumok általi megkötése energiafelhasználást igényel. A mellékvesevelő kromaffin granulátumaiban a katekolaminok szorosan kötődnek az ATP-hez (4:1 arányban) és specifikus fehérjékhez - kromograninokhoz -, ami megakadályozza a hormonok diffúzióját a granulátumokból a citoplazmába.
A katekolaminok szekréciójának közvetlen ingere nyilvánvalóan a kalcium behatolása a sejtbe, stimulálva az exocitózist (a szemcsemembrán fúziója a sejtfelszínnel és azok repedése az oldható tartalom - katekolaminok, dopamin-béta-hidroxiláz, ATP és kromograninok - teljes felszabadulásával az extracelluláris folyadékba).
A katekolaminok élettani hatásai és hatásmechanizmusa
A katekolaminok hatása a célsejtek specifikus receptoraival való kölcsönhatással kezdődik. Míg a pajzsmirigy- és szteroidhormonok receptorai a sejteken belül lokalizálódnak, a katekolaminok (valamint az acetilkolin és a peptidhormonok) receptorai a sejt külső felszínén találhatók.
Régóta ismert, hogy bizonyos reakciókkal kapcsolatban az adrenalin vagy a noradrenalin hatékonyabb, mint a szintetikus katekolamin izoproterenol, míg másokkal kapcsolatban az izoproterenol hatása felülmúlja az adrenalin vagy a noradrenalin hatását. Ennek alapján kidolgoztak egy koncepciót kétféle adrenoreceptor jelenlétéről a szövetekben: alfa és béta, és némelyikben csak e két típus egyike lehet jelen. Az izoproterenol a béta-adrenoreceptorok legerősebb agonistája, míg a szintetikus fenilefrin vegyület az alfa-adrenoreceptorok legerősebb agonistája. A természetes katekolaminok - az adrenalin és a noradrenalin - mindkét típusú receptorral képesek kölcsönhatásba lépni, de az adrenalin nagyobb affinitást mutat a béta-, a noradrenalin pedig az alfa-receptorok iránt.
A katekolaminok erősebben aktiválják a szív béta-adrenerg receptorait, mint a simaizom béta-receptorait, ami lehetővé tette a béta típus altípusokra osztását: béta1-receptorok (szív, zsírsejtek) és béta2-receptorok (hörgők, erek stb.). Az izoproterenol béta1-receptorokra gyakorolt hatása mindössze 10-szerese az adrenalin és a noradrenalin hatásának, míg a béta2-receptorokra 100-1000-szer erősebben hat, mint a természetes katekolaminok.
Specifikus antagonisták (fentolamin és fenoxibenzamin az alfa-, illetve propranolol a béta-receptorok esetében) alkalmazása megerősítette az adrenoreceptorok osztályozásának megfelelőségét. A dopamin képes kölcsönhatásba lépni mind az alfa-, mind a béta-receptorokkal, de különböző szövetek (agy, agyalapi mirigy, erek) is rendelkeznek saját dopaminerg receptorokkal, amelyek specifikus blokkolója a haloperidol. A béta-receptorok száma sejtenként 1000 és 2000 között változik. A katekolaminok béta-receptorok által közvetített biológiai hatásai általában az adenilát-cikláz aktiválódásával és a cAMP intracelluláris tartalmának növekedésével járnak. Bár a receptor és az enzim funkcionálisan összekapcsolódik, különböző makromolekulákról van szó. A guanozin-trifoszfát (GTP) és más purin nukleotidok részt vesznek az adenilát-cikláz aktivitásának modulálásában a hormon-receptor komplex hatása alatt. Az enzimaktivitás növelésével úgy tűnik, hogy csökkentik a béta-receptorok affinitását az agonisták iránt.
A denervált struktúrák fokozott érzékenységének jelensége régóta ismert. Épp ellenkezőleg, az agonistáknak való hosszan tartó kitettség csökkenti a célszövetek érzékenységét. A béta-receptorok vizsgálata lehetővé tette ezen jelenségek magyarázatát. Kimutatták, hogy az izoproterenolnak való hosszan tartó kitettség az adenilát-cikláz érzékenységének elvesztéséhez vezet a béta-receptorok számának csökkenése miatt.
A deszenzitizáció folyamata nem igényli a fehérjeszintézis aktiválódását, és valószínűleg az irreverzibilis hormon-receptor komplexek fokozatos kialakulásának köszönhető. Épp ellenkezőleg, a 6-oxidopamin bevezetése, amely elpusztítja a szimpatikus végződéseket, a reagáló béta-receptorok számának növekedésével jár a szövetekben. Lehetséges, hogy a szimpatikus idegi aktivitás növekedése a vérerek és a zsírszövet életkorral összefüggő deszenzitizációját is okozza a katekolaminokhoz képest.
A különböző szervekben található adrenoreceptorok számát más hormonok szabályozhatják. Így az ösztradiol növeli, a progeszteron pedig csökkenti az alfa-adrenoreceptorok számát a méhben, amit a katekolaminokra adott összehúzódási válaszának megfelelő növekedése és csökkenése kísér. Ha a béta-receptor agonisták hatására képződő intracelluláris "másodlagos hírvivő" minden bizonnyal a cAMP, akkor az alfa-adrenerg hatások közvetítőjével kapcsolatos helyzet bonyolultabb. Különböző mechanizmusok létezését feltételezik: a cAMP szintjének csökkenése, a cAMP-tartalom növekedése, a sejtek kalciumdinamikájának modulációja stb.
A szervezetben a különféle hatások reprodukálásához általában 5-10-szer kisebb adrenalin dózisokra van szükség, mint a noradrenaliné. Bár utóbbi hatékonyabb az α- és béta1-adrenoreceptorokkal szemben, fontos megjegyezni, hogy mindkét endogén katekolamin képes kölcsönhatásba lépni mind az alfa-, mind a béta-receptorokkal. Ezért egy adott szerv adrenerg aktivációra adott biológiai válasza nagymértékben függ a benne jelen lévő receptorok típusától. Ez azonban nem jelenti azt, hogy a szimpatikus-mellékvese rendszer idegi vagy humorális kapcsolatának szelektív aktiválása lehetetlen. A legtöbb esetben a különböző kapcsolatainak fokozott aktivitása figyelhető meg. Így általánosan elfogadott, hogy a hipoglikémia reflexszerűen aktiválja a mellékvesevelőt, míg a vérnyomás csökkenését (poszturális hipotenzió) főként a noradrenalin felszabadulása kíséri a szimpatikus idegek végeiből.
Adrenoreceptorok és aktivációjuk hatásai különböző szövetekben
Szervrendszer |
Adrenerg receptor típus |
Reakció |
Szív- és érrendszer: |
||
Szív |
Béta |
Megnövekedett pulzusszám, vezetőképesség és összehúzódási képesség |
Arteriolák: |
||
Bőr és nyálkahártyák |
Alfa |
Csökkentés |
Váziizmok |
Béta |
Tágulás Összehúzódás |
Hasi szervek |
Alfa (több) |
Csökkentés |
Béta |
Kiterjesztés |
|
Vénák |
Alfa |
Csökkentés |
Légzőrendszer: |
||
A hörgők izmai |
Béta |
Kiterjesztés |
Emésztőrendszer: |
||
Gyomor |
Béta |
Csökkent motoros készségek |
Belek |
Alfa |
A záróizmok összehúzódása |
Lép |
Alfa |
Csökkentés |
Béta |
Pihenés |
|
Exokrin hasnyálmirigy |
Alfa |
Csökkent szekréció |
Urogenitális rendszer: |
Alfa |
Záróizom-összehúzódás |
Hólyag |
Béta |
A kidobóizom ellazulása |
Férfi nemi szervek |
Alfa |
Ejakuláció |
Szemek |
Alfa |
Pupillatágulat |
Bőr |
Alfa |
Fokozott izzadás |
Nyálmirigyek |
Alfa |
Kálium és víz kiválasztása |
Béta |
Amiláz szekréció |
|
Endokrin mirigyek: |
||
A hasnyálmirigy szigetei |
||
Béta-sejtek |
Alfa (több) |
Csökkent inzulinelválasztás |
Béta |
Fokozott inzulinszekréció |
|
Alfa sejtek |
Béta |
Fokozott glukagon szekréció |
8 cellás |
Béta |
Fokozott szomatosztatin szekréció |
Hipotalamusz és agyalapi mirigy: |
||
Szomatotrófok |
Alfa |
Fokozott STH-szekréció |
Béta |
Csökkent STH szekréció |
|
Laktotrofok |
Alfa |
A prolaktin csökkent szekréciója |
Tireotrófok |
Alfa |
Csökkent TSH-szekréció |
Kortikotropok |
Alfa |
Fokozott ACTH-szekréció |
| béta | Csökkent ACTH-szekréció | |
Pajzsmirigy: |
||
Follikuláris sejtek |
Alfa |
A tiroxin csökkent szekréciója |
Béta |
Fokozott tiroxin-szekréció |
|
Parafollikuláris (K) sejtek |
Béta |
Fokozott kalcitonin szekréció |
Mellékpajzsmirigyek |
Béta |
Fokozott PTH-szekréció |
Vese |
Béta |
Fokozott renin szekréció |
Gyomor |
Béta |
Fokozott gasztrin szekréció |
BX |
Béta |
Megnövekedett oxigénfogyasztás |
Máj |
? |
Fokozott glikogenolízis és glükoneogenezis glükóz felszabadulásával; fokozott ketogenezis ketontestek felszabadulásával |
Zsírszövet |
Béta |
Fokozott lipolízis szabad zsírsavak és glicerin felszabadulásával |
Váziizmok |
Béta |
Fokozott glikolízis piruvát és laktát felszabadulásával; csökkent proteolízis alanin és glutamin felszabadulásának csökkenésével |
Fontos figyelembe venni, hogy a katekolaminok intravénás adagolásának eredményei nem mindig tükrözik megfelelően az endogén vegyületek hatásait. Ez főként a noradrenalinre vonatkozik, mivel a szervezetben főként nem a vérbe, hanem közvetlenül a szinaptikus hasadékokba szabadul fel. Ezért az endogén noradrenalin például nemcsak az érrendszeri alfa-receptorokat aktiválja (megnövekedett vérnyomás), hanem a szív béta-receptorait is (megnövekedett pulzusszám), míg a kívülről bevitt noradrenalin főként az érrendszeri alfa-receptorok aktiválódásához és a szívverés reflexszerű (a vagus idegén keresztüli) lassulásához vezet.
Az adrenalin alacsony dózisai főként az izomerek és a szív béta-receptorait aktiválják, ami a perifériás érrendszeri ellenállás csökkenéséhez és a perctérfogat növekedéséhez vezet. Bizonyos esetekben az első hatás érvényesülhet, és az adrenalin beadása után hipotenzió alakulhat ki. Nagyobb dózisokban az adrenalin az alfa-receptorokat is aktiválja, amit a perifériás érrendszeri ellenállás növekedése kísér, és a perctérfogat növekedésének hátterében a vérnyomás növekedéséhez vezet. Az érrendszeri béta-receptorokra gyakorolt hatása azonban megmarad. Ennek eredményeként a szisztolés nyomás növekedése meghaladja a diasztolés nyomás hasonló mutatóját (a pulzusnyomás növekedése). Még nagyobb dózisok bevezetésével az adrenalin alfa-mimetikus hatásai kezdenek érvényesülni: a szisztolés és a diasztolés nyomás párhuzamosan emelkedik, ahogyan a noradrenalin hatása alatt is.
A katekolaminok anyagcserére gyakorolt hatása közvetlen és közvetett hatásokból áll. Az előbbiek főként a béta-receptorokon keresztül valósulnak meg. Az összetettebb folyamatok a májhoz kapcsolódnak. Bár a fokozott májglikogenolízist hagyományosan a béta-receptorok aktivációjának tekintik, az alfa-receptorok részvételére is vannak bizonyítékok. A katekolaminok közvetett hatásai számos más hormon, például az inzulin szekréciójának modulálásával járnak. Az adrenalin szekréciójára gyakorolt hatásában az alfa-adrenerg komponens egyértelműen dominál, mivel kimutatták, hogy bármilyen stressz az inzulin szekréció gátlásával jár.
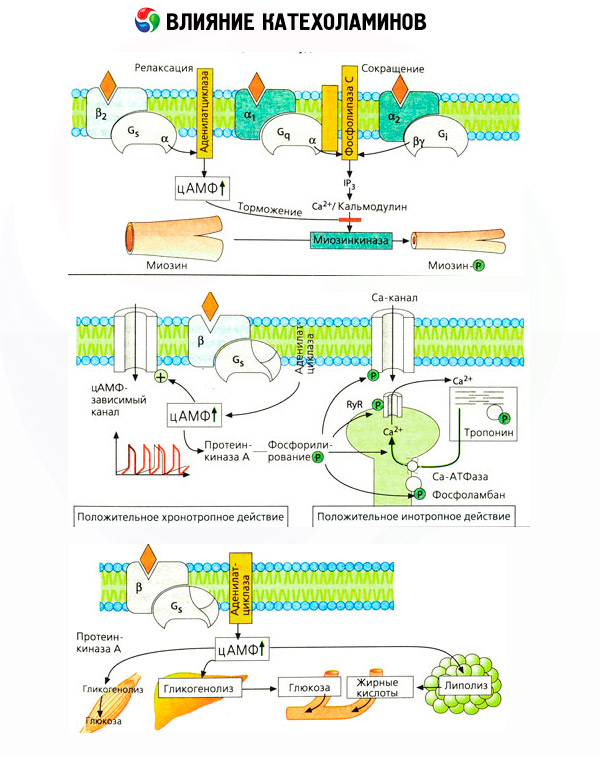
A katekolaminok közvetlen és közvetett hatásainak kombinációja hiperglikémiát okoz, ami nemcsak a fokozott máj glükóztermeléssel jár, hanem a perifériás szövetek általi felhasználásának gátlásával is. A lipolízis felgyorsulása hiperlipacidémiát okoz, ami fokozott zsírsav-szállítást eredményez a májban, és fokozza a ketontest-termelést. Az izmokban a fokozott glikolízis a laktát és a piruvát vérbe történő felszabadulásának növekedéséhez vezet, amelyek a zsírszövetből felszabaduló glicerinnel együtt a máj glükoneogenezisének prekurzoraiként szolgálnak.
A katekolamin szekréció szabályozása. A szimpatikus idegrendszer és a mellékvesevelő termékeinek és reakciómódjainak hasonlósága képezte az alapját ezen struktúrák egyetlen szimpatikus-mellékvese rendszerbe való egyesítésének, idegi és hormonális kapcsolatainak elosztásával. Különböző afferens jelek koncentrálódnak a hipotalamuszban, valamint a gerincvelő és a nyúltvelő központjaiban, ahonnan az efferens üzenetek származnak, és a gerincvelő oldalsó szarvaiban, a VIII. nyaki - II-III. ágyéki szegmensek szintjén található preganglionos neuronok sejtes testeire váltanak.
Ezen sejtek preganglionáris axonjai elhagyják a gerincvelőt, és szinaptikus kapcsolatokat képeznek a szimpatikus lánc ganglionjaiban található neuronokkal vagy a mellékvese velősejtjeivel. Ezek a preganglionáris rostok kolinergek. Az első alapvető különbség a szimpatikus posztganglionáris neuronok és a mellékvese velő kromaffin sejtjei között az, hogy az utóbbiak az általuk vett kolinerg jelet nem idegvezetéssel (posztganglionáris adrenerg idegek), hanem humorális úton továbbítják, adrenerg vegyületeket szabadítva fel a vérbe. A második különbség az, hogy a posztganglionáris idegek norepinefrint termelnek, míg a mellékvese velősejtjei főként adrenalint. Ez a két anyag eltérő hatással van a szövetekre.

