A cikk orvosi szakértője
Új kiadványok
A katecholaminok szintézise, szekréciója és anyagcseréje
Utolsó ellenőrzés: 19.10.2021

Minden iLive-tartalmat orvosi szempontból felülvizsgáltak vagy tényszerűen ellenőriznek, hogy a lehető legtöbb tényszerű pontosságot biztosítsák.
Szigorú beszerzési iránymutatásunk van, és csak a jó hírű média oldalakhoz, az akadémiai kutatóintézetekhez és, ha lehetséges, orvosilag felülvizsgált tanulmányokhoz kapcsolódik. Ne feledje, hogy a zárójelben ([1], [2] stb.) Szereplő számok ezekre a tanulmányokra kattintható linkek.
Ha úgy érzi, hogy a tartalom bármely pontatlan, elavult vagy más módon megkérdőjelezhető, jelölje ki, és nyomja meg a Ctrl + Enter billentyűt.
A mellékvese agyi rétege a vegyület szteroidjaitól távol eső vegyületet termel. Ezek egy 3,4-dihidroxi-fenil (katekol) magot tartalmaznak és katecholaminokat neveznek. Ezek közé tartozik az adrenalin, a noradrenalin és a dopamin-béta-oxi-tiramin.
Sequence katekolamin szintézis igen egyszerű: Tirozin → dihidroxi (DOPA) → → dopamin norepinefrin → adrenalin. A tirozin táplálékkal belép a szervezetbe, de fenilalaninból is előállítható a májban fenilalanin-hidroxiláz hatására. A tirozin transzformációjának végtermékei különbözőek a szövetekben. A mellékvesevelő a folyamat lépéssel folytatódik adrenalin képződését, végein a szimpatikus idegek - noradrenalin, bizonyos neuronok a központi idegrendszer katekolamin dopamin szintézis befejeződött formában.
A tirozin DOPA-ba történő átalakítását tirozin-hidroxiláz katalizálja, amelynek kofaktora a tetrahidrobiotterin és az oxigén. Úgy gondolják, hogy ez az enzim korlátozza a teljes katekolamin bioszintézis folyamat sebességét, és gátolja az eljárás végtermékei. A tirozin-hidroxiláz a katecholaminok bioszintézisére gyakorolt szabályozási hatások fő célja.
Dopa dopaminná konverzió enzim katalizálja dopa-dekarboxiláz (kofaktor - piridoxál), amely viszonylag nem-specifikus és dekarboxilezzük, és más aromás L-aminosav. Azonban vannak utalások a katecholaminok szintézisének módosítására a aktivitás és az enzim megváltoztatásával. Bizonyos neuronokban nincsenek enzimek a dopamin további átalakításához, és ez a végtermék. Más szövetek dopamin-béta-hidroxilázt tartalmaznak (a kofaktorok réz, aszkorbinsav és oxigén), amely a dopamint noradrenalinná alakítja. A mellékvesevelő (de nem szimpatikus idegvégződésekből) van jelen feniletanolamin - metiltranszferáz képező adrenalin a noradrenalin. Ebben az esetben a metilcsoportok donorja az S-adenozil-metionin.
Fontos megjegyezni, hogy a szintézis a feniletanolamin-N-Metiltransferazy által indukált glükokortikoidok tartoznak agykéreg réteg a portál vénás rendszer. Ez megmagyarázhatja azt a tényt, hazugság kombinálva két különböző belső elválasztású mirigyek egy test. Jelentése glükokortikoid szintézis adrenalin aláhúzza az a tény, hogy a mellékvesevelő termelő sejtek norepinefrin, köré artériákban, míg a vérsejtek kapunk adrenalinprodutsiruyuschie lényegében vénás orrmelléküregek, lokalizált a mellékvese kéregben.
A összeomlása katecholaminok fordul elő, főleg a hatása alatt két enzimrendszerek: katekol-O-metiltranszferáz (COMT) és monoamin-oxidáz (MAO). A fő módja epinefrin és norepinefrin bomlás ábrán vázlatosan bemutattuk. 54. Az intézkedés alapján COMT jelenlétében egy donor metilcsoportok S-adrenozilmetionina katekolaminok és átalakítjuk normetanephrin metanephrin (3-O-metil-származékok epinefrin és norepinefrin), amelyek hatása alatt a MAO átalakult aldehidek és több (jelenlétében aldehid) a vanillil-mandulasav sav (ICH) - a fő bomlástermék a noradrenalin és az adrenalin. Ugyanebben az esetben, amikor először kitéve katekolaminok MAO fellépés, nem COMT, azok alakítjuk 3,4-dioksimindalevy aldehidet, majd hatása alatt az aldehid és a COMT - 3,4-dioksimindalnuyu sav és a méhen belüli eszköz. Jelenlétében alkohol-dehidrogenáz a katecholaminok alkothat 3-metoxi-4-oksifenilglikol, a fő végtermék lebomlási adrenalin és noradrenalin a központi idegrendszerben.
A szétesési dopamin Hasonlóan folytatódik, kivéve, hogy annak metabolitjai mentesek hidroxilcsoportok a béta-szénatom, és ezért, ahelyett, vanillil-mandulasav képződött homovanillinsav (HVA) és 3-metoxi-4-oksifeniluksusnaya sav.
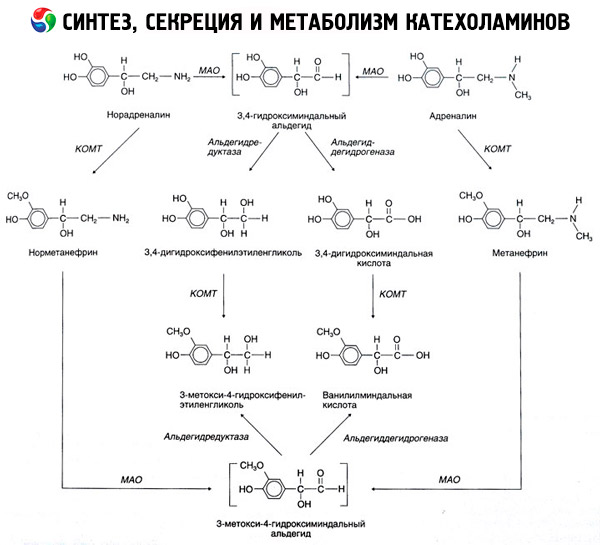
A katecholaminok molekulájának oxidációjára szolgáló quinoid útvonal létezését, amelyre kiterjedő biológiai aktivitással rendelkező köztes termékeket is feltételezhetünk.
Hatására kialakuló, a citoszol enzimek, adrenalin és noradrenalin szimpatikus idegvégződéseken, adrenal medulla, és adja a szekréciós granulátumok, amely védi őket a hatását lebontó enzimek. A katekolaminok granulátummal való megkötése energiaköltséget igényel. A kromaffin granulátum A mellékvese-velő katekolaminok erősen kötődik, ATP-t (a aránya 4: 1) és a specifikus fehérjék - chromogranin amely megakadályozza diffúzióját hormonok a szemcsék a citoplazmában.
Közvetlen inger katekolamin látszólag penetráció kalcium-sejt-stimuláló exocitózis (fúziós membrán granulákat összekeverjük a sejtfelszíni és azok szakadék a összhozama oldható tartalom - a katecholaminok, dopamin-béta-hidroxiláz, ATP-t és kromogranin - az extracelluláris folyadékban) .
A katekolaminok élettani hatásai és működésük mechanizmusa
A katecholaminok hatása a célsejtek specifikus receptorainak kölcsönhatásával kezdődik. Ha a pajzsmirigy és a szteroid hormon receptorai a sejtek belsejében lokalizálódnak, akkor a katecholamin receptorok (valamint acetilkolin és peptid hormonok) a külső sejtfelszínen jelen vannak.
Régóta megállapították, hogy egy része tekintetében reakciók adrenalin vagy a noradrenalin hatékonyabbak, mint a szintetikus katekolamin izoproterenol, míg mások a hatás felülmúlja az intézkedés izoproterenol adrenalin vagy noradrenalin. Ennek alapján ezt a fogalmat a jelen két típusú szövetek került kifejlesztésre adrenerg alfa és béta, és csak ezek bármelyike két típusú lehet jelen néhány közülük. Az izoproterenol a leghatásosabb agonista a béta-adrenerg receptorokat, míg a szintetikus vegyületek fenilefrin - a leghatásosabb agonista az alfa-adrenerg receptorok. Természetes katekolaminok - adrenalin és noradrenalin - képesek kölcsönhatásba a receptorokhoz az mindkét típusú, de az adrenalin vesz nagyobb az affinitása a béta, és a norepinefrin - alfa-receptorok.
A katekolaminok erősebb aktiválja kardiális béta-adrenerg receptorokra, mint a béta-receptorok a simaizom, amely lehetővé teszi a béta-típusú oszlik altípusok: béta1-receptorok (szív, zsírsejtek) és béta2-receptorok (hörgők, vérerek, stb ...). Az akció a izoproterenol béta1 receptor jobb hatást az adrenalin és noradrenalin csak 10-szer, míg a béta2-receptorok úgy viselkedik, 100-1000-szor hatásosabb, mint a természetes katekolamin.
Alkalmazás specifikus antagonisták (fenoxi-benzamin és a fentolamin ellen alfa- és propranolol elleni béta-receptor) igazolta a besorolása adrenoceptorok. A dopamin képes kölcsönhatásba léphetnek mind az alfa- és béta-receptorokat, de a különböző szövetekben (agy, agyalapi mirigy, hajók) található, és saját dopaminerg receptorok specifikus blokkoló, amely haloperidol. A béta-receptorok száma sejtenként 1000-2000. Biológiai hatások katekolaminok által közvetített béta-receptorok kapcsolódnak, mint általában, a aktiválása adenilát-cikláz és a megnövekedett intracelluláris cAMP-t. A receptor és az enzim, jóllehet funkcionálisan kapcsolódnak egymáshoz, de különböző makromolekulákat képviselnek. A modulációs adenilát-cikláz-aktivitás hatása alatt a hormon-receptor komplex részt guanozin-trifoszfát (GTP) és más purin nukleotidok. Az enzim aktivitásának növelésével úgy tűnik, hogy csökkenti a béta-receptorok affinitását az agonisták számára.
A denervált szerkezetek érzékenységének növelése már régóta ismert. Ezzel szemben az agonisták hosszú ideig tartó expozíciója csökkenti a célszövetek érzékenységét. A béta-receptorok tanulmányozása lehetővé tette ezeknek a jelenségeknek a megmagyarázását. Kimutatták, hogy az izoproterenol elhúzódó hatása az adenilát-cikláz érzékenységének csökkenését eredményezi a béta-receptorok számának csökkenése miatt.
A deszenzibilizációs folyamat nem igényli a fehérjeszintézis aktiválását, és valószínűleg az irreverzibilis hormon-receptor komplexek fokozatos kialakulása. Éppen ellenkezőleg, a szimpatikus célt megszakító 6-oxidfaminnak a szöveti szövetben lévő béta-receptorok számának növekedése társul. Nem zárható ki, hogy a szimpatikus idegi aktivitás növekedése meghatározza a vérerek és a zsíros szövetek katecholaminokkal kapcsolatos korral összefüggő deszenzitizációját.
A különböző szervekben lévő adrenoreceptorok számát más hormonok szabályozzák. Így növeli ösztradiol, a progeszteron és számának csökkentése alfa-adrenerg receptorok a méhben, ami ahhoz megfelelő növekedését és csökkenését annak összehúzódási válasz katekolaminok. Ha intracelluláris „második messenger”, hatására kialakuló, a béta-receptor agonisták, biztosan van cAMP, viszonyítva az adó az alfa-adrenerg hatások sokkal bonyolultabb. Feltételezhető, hogy különböző mechanizmusok léteznek: a cAMP szintjének csökkenése, a cAMP tartalom növekedése, a kalcium sejtdinamikájának modulációja,
A különböző hatások reprodukálására a szervezetben rendszerint az epinefrin adagjai, amelyek 5-10-szer alacsonyabbak, mint a noradrenalin. Bár az utóbbi hatékonyabb képest a- és béta-1-adrenerg receptorok, fontos megjegyezni, hogy mind az endogén katekolamin-képes kölcsönhatásba lépni mind a alfa- és béta-receptorok. Ezért a szervezet biológiai választ adrenerg aktiválásra nagymértékben függ a benne lévő receptorok típusától. Ez azonban nem jelenti azt, hogy lehetetlen a szimpatikus-mellékvese rendszer idegi vagy humorális kapcsolatának szelektív aktiválása. A legtöbb esetben a különböző kapcsolatok fokozott aktivitása van. Így, azt feltételezzük, hogy az aktiválja reflex hipoglikémia mellékvesevelő, míg a vérnyomáscsökkenés (ortosztatikus hipotenzió) kíséretében elsősorban norepinefrin felszabadítását a szimpatikus idegvégződésekből.
Adrenoreceptorok és aktiválásuk hatásai különböző szövetekben
|
Rendszer, szerv |
Adrenoceptor típusú |
Reakció |
|
Kardiovaszkuláris rendszer: |
||
|
Szív |
Beta |
A összehúzódások, a vezetés és a kontraktilitás gyakoriságának növelése |
|
Arteriolák: |
||
|
A bőr és a nyálkahártyák |
Alfa |
Csökkentés |
|
A vázizmok |
Beta |
Kiterjesztés csökkentése |
|
Hasi szervek |
Alfa (több) |
Csökkentés |
|
Beta |
Kiterjesztés |
|
|
Bécs |
Alfa |
Csökkentés |
|
Légzőrendszer: |
||
|
Hörgő izmok |
Beta |
Kiterjesztés |
|
Az emésztőrendszer: |
||
|
Gyomor |
Beta |
Csökkentett motorfunkció |
|
Belek |
Alfa |
A sphincterek csökkentése |
|
Lép |
Alfa |
Csökkentés |
|
Beta |
Pihenés |
|
|
A hasnyálmirigy külsőleg titkos része |
Alfa |
Csökkentett szekréció |
|
Genitourinary rendszer: |
Alfa |
Szfinxek csökkentése |
|
Hólyag |
Beta |
Az ördögűző izom relaxálása |
|
Férfi nemi szervek |
Alfa |
Ejakuláció |
|
Szemek |
Alfa |
A diák kitágult |
|
Bőr |
Alfa |
Fokozott izzadás |
|
Nyálmirigyek |
Alfa |
Kálium és víz elkülönítése |
|
Beta |
Az amiláz kiválasztása |
|
|
Endokrin mirigyek: |
||
|
A hasnyálmirigy-szigetek |
||
|
Béta-sejtek |
Alfa (több) |
Csökkent az inzulinszekréció |
|
Beta |
Megnövekedett inzulinszekréció |
|
|
Alfa sejtek |
Beta |
A glukagon fokozott szekréciója |
|
8-sejt |
Beta |
A szomatosztatin fokozott szekréciója |
|
A hipotalamusz és az agyalapi mirigy: |
||
|
Somatotrofы |
Alfa |
Az STH fokozott szekréciója |
|
Beta |
Az STH csökkent szekréciója |
|
|
Laktotrofы |
Alfa |
A prolaktin csökkent kiválasztása |
|
Tireotrofy |
Alfa |
A TSH csökkenése |
|
Kortikotrofy |
Alfa |
Az ACTH fokozott szekréciója |
| beta | Az ACTH csökkent kiválasztása | |
|
Pajzsmirigy: |
||
|
Follicularis sejtek |
Alfa |
Csökkent a tiroxin szekréciója |
|
Beta |
A tiroxin fokozott szekréciója |
|
|
Parafolikuláris (K) sejtek |
Beta |
A kalcitonin fokozott szekréciója |
|
A mellékpajzsmirigyek |
Beta |
A PTH fokozott szekréciója |
|
Vese |
Beta |
Megnövekedett reninszekréció |
|
Gyomor |
Beta |
Növelje a gasztrin szekréciót |
|
Alapvető csere |
Beta |
Az oxigénfogyasztás növekedése |
|
A máj |
? |
A glükóztermelés növekedése a glükogenolízisben és a glükoneogenezisben; növelik a ketogenezist keton testek felszabadításával |
|
Adipoid szövet |
Beta |
A lipolízis növekedése szabad zsírsavak és glicerin felszabadításával |
|
Vázizmok |
Beta |
Glikolízis növelése piruvát és laktát felszabadításával; a proteolízis csökkenése az alanin, glutamin hozamának csökkenésével |
Fontos szem előtt tartani, hogy az eredmények intravénás beadása katekolamin nem mindig tükrözik megfelelően a hatását az endogén vegyületek. Ez főként a noradrenalin, mert áll a szervezet főleg nem a vér, hanem közvetlenül a szinaptikus résben. Ezért endogén norepinefrin aktiválja, például, nem csak a vaszkuláris alfa-receptorok (megnövekedett vérnyomás), hanem a szív béta-receptorok (palpitáció), míg A noradrenalin külső kezelve döntően aktiválását vaszkuláris alfa-receptor és a reflex (via a vagus) lassuló szívdobbanás.
Alacsony dózisú adrenalin aktiválja elsősorban az izomrostok és a szív béta receptorát, ezáltal csökken a perifériás érrendszeri rezisztencia, és növeli a szív percnyi térfogatát. Egyes esetekben az első hatás dominálhat, és az adrenalin beadását követően hipotenzió alakul ki. Magasabb dózisoknál a adrenalin és aktiválja az alfa-receptorok kíséri megnövekedett perifériás vaszkuláris rezisztencia és a szívteljesítmény háttérnövekedés vezet megnövekedett vérnyomás. Azonban az érrendszeri béta-receptorokra gyakorolt hatása is megmarad. Ennek eredményeként a szisztolés nyomás növekedése meghaladja a diasztolés nyomás hasonló értékét (impulzusnyomás emelkedése). Még nagyobb dózisok bevezetésével az epinefrin alfa-mimetikus hatásai kezdenek érvényesülni: a szisztolés és a diasztolés nyomásnövekedés párhuzamosan, mind a noradrenalin hatására.
A katecholaminok metabolizmusra gyakorolt hatása közvetlen és közvetett hatásokból áll. Az első főleg a béta-receptorokon keresztül valósul meg. Bonyolultabb folyamatok kapcsolódnak a májhoz. Bár a máj glikogenolízis fokozását hagyományosan a béta-receptor aktiváció eredményének tekintették, itt is vannak adatok az alfa-receptorok részvételéről. A katecholaminok mediált hatásai sok más hormon, például az inzulin szekréciójának modulációjához kapcsolódnak. Az adrenalin kiválasztódása során az alfa-adrenerg komponens egyértelműen túlsúlyban van, mivel kimutatták, hogy bármely stresszhez az inzulin szekréció gátlása társul.
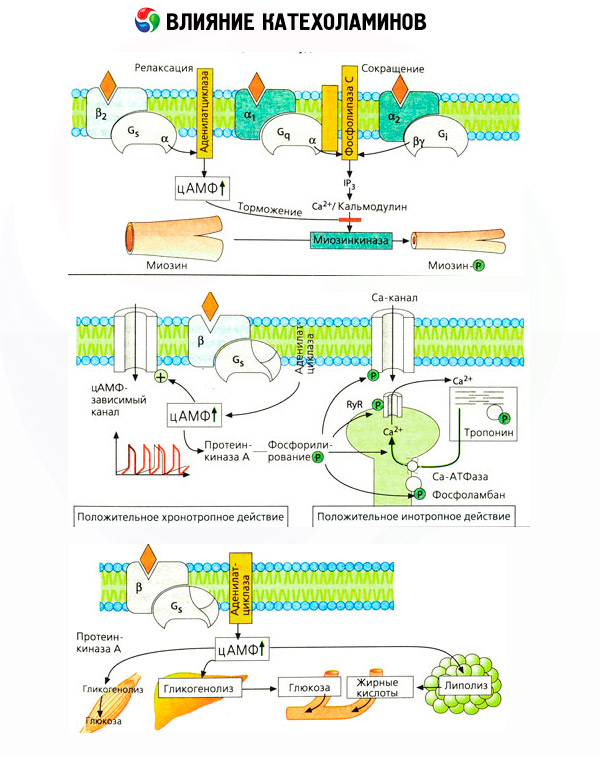
A katecholaminok közvetlen és közvetett hatásainak kombinációja hyperglykaemiát okoz, nemcsak a glükóz májtermelésének növekedésével, hanem a perifériás szövetek általi felhasználásának gátlásával is. A lipolízis gyorsulása hiperlipacidémiát okoz a zsírsavak fokozott méhszaporításával és a keton testek termelésének fokozásával. Az izomzat glikolízisének növekedése a laktát és piruvát vérben való felszabadulásához vezet, ami a zsírszövetből felszabaduló glicerinnel együtt a máj glukoneogenezis prekurzoraként szolgál.
A katecholaminok szekréciójának szabályozása. A hasonlóság a termékek és eljárások választ a szimpatikus idegrendszer és a mellékvesevelő volt az alapja a kombinálásával ezek a szerkezetek egyetlen testet sympathoadrenalis rendszer kiadás idegi és hormonális annak linket. Különböző afferens jelek koncentrálódnak a hipotalamuszban és központok a gerincvelő és a medulla oblongata amelyből erednek az efferens parcella bekapcsolás preganglionic idegsejttestből található oldalsó szarv a gerincvelő szintjén a nyaki VIII - II-III lumbális szegmensek.
Preganglionic axonok Ezeknek a sejteknek elhagyja a gerincvelő és az alkotnak szinaptikus kapcsolatokat a neuronok lokalizált a ganglionokban a szimpatikus lánc, vagy a mellékvese velő sejteket. Ezek a preganglionos rostok kolinergek. Az első alapvető különbség az posztganglionális szimpatikus neuronok és a mellékvesevelő kromaffin sejteket abban áll, hogy az utóbbi továbbítják a bejövő jelet úgy koiinerg vezetési (posztganglionáris adrenerg idegek) és humorális kiemelésével adrenerg vegyület vér. A második különbség csökken posztganglionos idegeket, hogy termelnek norepinefrin, míg a mellékvesevelő sejtek - előnyösen adrenalin. Ez a két anyag eltérő hatást gyakorol a szövetre.

